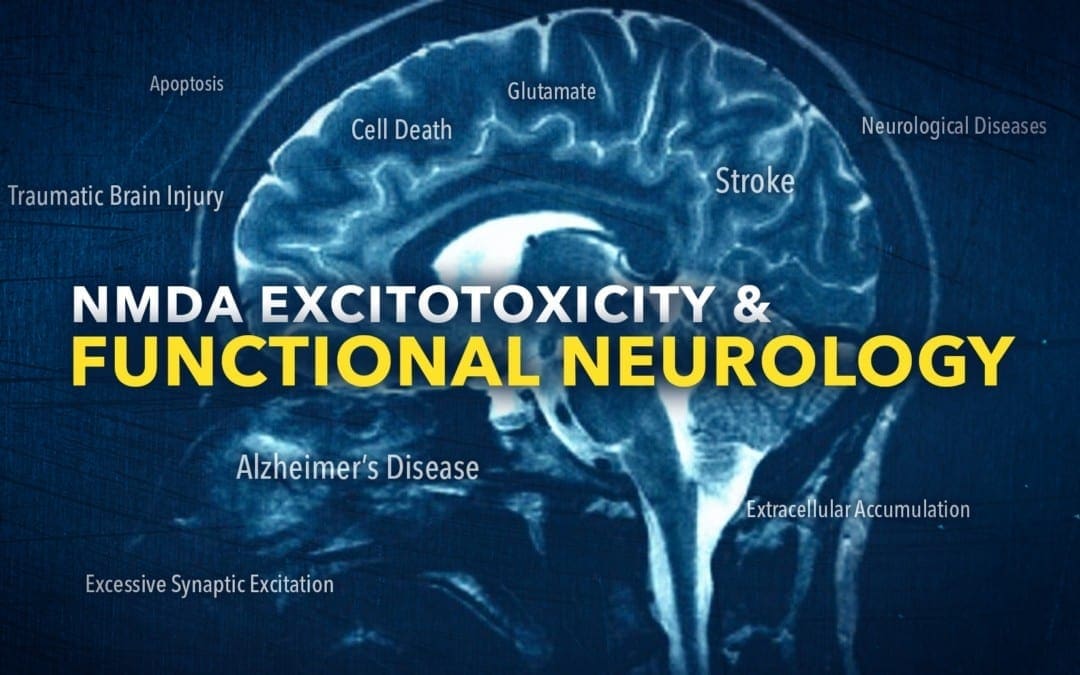
L'eccitotossicità è un meccanismo patologico visto in una varietà di problemi di salute in cui un'eccitazione sinaptica eccessiva causa la morte neuronale e si ritiene anche che sia causata dall'accumulo extracellulare del neurotrasmettitore eccitatorio glutammato, che innesca e collega l'N-metil-D-aspartato glutammatergico ionotropico recettori (NMDAR) nel cervello. In generale, gli NMDAR regolano e mantengono il calcio nelle cellule per aiutare a gestire i meccanismi fisiologici come la plasticità sinaptica e la memoria, tuttavia, una stimolazione eccessiva può alla fine aumentare il calcio intracellulare che innesca la segnalazione di morte cellulare per attivare l'apoptosi. Questo meccanismo patologico è stato suggerito in una varietà di problemi di salute, come lesioni cerebrali traumatiche (TBI) e malattia di Alzheimer (AD), dove viene ampiamente esaminato per comprendere i problemi di salute e gli approcci terapeutici. In un ictus, l'eccitotossicità ha dimostrato di essere il principale meccanismo patologico in cui si verifica il danno neuronale ed è considerato un obiettivo ben noto per molti recenti tentativi di sviluppo di terapie per l'ictus.
L'ictus è un problema acuto di salute del cervello che causa danni neuronali che attualmente non ha approcci di trattamento neuroprotettivo sicuro ed efficace. Immediatamente dopo un ictus, il tessuto cerebrale perde la perfusione sanguigna e il centro dell'infarto si deteriora rapidamente. Ciò provoca quindi un'ischemia più lieve e molte cellule cerebrali o neuroni si tradurrà in una morte ritardata che può richiedere fino a diverse ore o addirittura giorni. Studi di ricerca mostrano che il meccanismo della morte cellulare è principalmente l'eccitotossicità dipendente dal recettore NMDA. Nelle aree ischemiche, i livelli di glutammato extracellulare aumentano prevenendo il rilascio di glutammato, l'attività sinaptica o l'attivazione NMDAR che era in grado di limitare la morte cellulare in una varietà di modelli di ictus. Pertanto, prevenire l'eccitotossicità è un approccio terapeutico importante per ridurre il danno cerebrale e migliorare le misure di esito del paziente a seguito di un ictus, e questo ha sicuramente incoraggiato ampi sforzi verso lo sviluppo di approcci di trattamento dell'ictus basati sul recettore NMDA negli ultimi due decenni. Purtroppo, questi hanno in gran parte ottenuto risultati piuttosto deludenti. Diversi studi di ricerca non sono riusciti a trovare l'efficienza attesa di NMDAR per ridurre le lesioni cerebrali. Le ragioni alla base dei risultati degli studi di ricerca di base e degli studi clinici sono ancora sconosciute, tuttavia sono state suggerite diverse ragioni. Questi includono, ma non sono limitati a, l'incapacità di utilizzare le dosi corrette necessarie per la neuroprotezione a causa dei loro effetti collaterali, l'incapacità di usare i farmaci entro le loro finestre neuroprotettive, i disegni sperimentali poveri e l'eterogeneità nella popolazione dei pazienti. Tuttavia, come riassumeremo brevemente nel seguente articolo, il miglioramento della nostra comprensione dei meccanismi fisiologici e patologici dell'attivazione NMDAR nonché dei diversi percorsi collegati a diversi sottotipi NMDAR, ha permesso ai ricercatori di sviluppare nuovi approcci terapeutici che migliorano le finestre terapeutiche e aumentare la specificità per le vie di segnalazione della morte, ottenendo la neuroprotezione senza interrompere altre vie di segnalazione essenziali a valle del recettore NMDAR.
Contenuti
Neuroprotectants Targeting Sottotipi NMDAR
I sottotipi NMDAR hanno scopi diversi in termini di eccitotossicità e fisiologia. Il NMDAR è un recettore che generalmente ha due subunità GluN1, note anche come NR1, nonché due subunità della sottofamiglia GluN2 (GluN2A-2D, noto anche come NR2A-2D). Nella corteccia, le principali sottopopolazioni di NMDAR sono i recettori contenenti GluN2A o GluN2A e 2B. I recettori contenenti GluN2A si trovano nelle sinapsi mentre i recettori contenenti GluN2B si trovano sulle membrane extrasinaptiche. I recettori contenenti GluN2A e GluN2B sono diversi l'uno dall'altro perché regolano e gestiscono la plasticità, favorendo il potenziamento a lungo termine (GluN2A) o la depressione (GluN2B) attraverso una varietà di proprietà elettrofisiologiche e farmacologiche nonché proteine di segnalazione. Inoltre, questi recettori svolgono un ruolo fondamentale nel promuovere la sopravvivenza cellulare (GluN2A) o la morte (GluN2B) dopo stimolazione eccitotossica. Poiché i recettori contenenti GluN2A sono principalmente focalizzati sulle sinapsi mentre i recettori contenenti GluN2B sono focalizzati sulle membrane sinaptiche ed extrasinaptiche, quando le condizioni eccitotossiche fanno sì che il glutammato si estenda oltre le sinapsi, la segnalazione di morte mediata da GluN2B diventa più forte rispetto alla segnalazione di sopravvivenza che alla fine si traduce in Morte. Attraverso un ictus, ad esempio, gli NMDAR hanno meno probabilità di favorire la sopravvivenza cellulare e possono invece causare effetti dannosi prevenendo considerevoli normali scopi fisiologici. Selfotel, un bloccante NMDAR non specifico, era neuroprotettivo contro l'ictus in vitro e in vivo, tuttavia, alla fine, non è riuscito a essere neuroprotettivo contro l'ictus negli studi clinici causando una serie di effetti collaterali intollerabili.
Le strategie di trattamento per ridurre gli effetti collaterali indesiderati, inclusi gli antagonisti del sito della glicina e miglioramenti specifici del sottotipo NMDAR, erano di indirizzare le regioni di legame della glicina allosterica sulle subunità GluN1 con licostinel e gavestinel invece di bloccare direttamente il recettore. Questi farmaci candidati hanno ottenuto buoni risultati negli esami preclinici, tuttavia, hanno anche fallito a causa della bassa efficienza nonostante i profili di effetti collaterali minimi. Gli effetti collaterali negativi erano forse dovuti a una finestra di tempo mancata a seguito di un ictus che mostra quali bloccanti del recettore sono sicuri ed efficaci nel prevenire la morte.
Migliori metodi e tecniche di trattamento per ridurre gli effetti collaterali indesiderati di NMDAR devono utilizzare le differenze tra le loro variazioni. Ad esempio, l'inibitore specifico di GluN2B traxoprodil è neuroprotettivo negli studi di ricerca sull'ictus e ha effetti collaterali minimi, tuttavia, ha anche fallito negli studi clinici. Simile agli antagonisti della regione della glicina, forse deve essere adeguatamente regolato e gestito per funzionare in modo efficiente. Gli agonisti di GluN2A dovrebbero promuovere la segnalazione di sopravvivenza cellulare che potrebbe consentire il recupero dopo un ictus e la sopravvivenza cellulare per impedire il passaggio di segnalazione. In effetti, l'attivazione dei recettori contenenti GluN2A utilizzando dosi aumentate di glicina era neuroprotettiva in un modello animale di ictus, ma ulteriori studi di ricerca devono esaminare l'attivazione di GluN2A come approccio terapeutico nei partecipanti umani.
Mentre gli antagonisti e i modulatori NMDAR sono sicuri ed efficaci nell'attenuare l'eccitotossicità nelle versioni sperimentali, il loro difetto è la sfida nell'implementare approcci terapeutici precocemente in coincidenza con il culmine del rilascio di glutammato eccitotossico. I pazienti colpiti da ictus spesso non hanno alcuna possibilità di ricevere questi approcci terapeutici in tempo. Tuttavia, il problema di salute può essere evitato se i bloccanti del recettore possono essere utilizzati nelle popolazioni a rischio. Uno studio di ricerca ha dimostrato che basse dosi di memantina profilattica, un antagonista NMDAR non competitivo con pochi effetti collaterali, possono ridurre considerevolmente le lesioni cerebrali e i deficit funzionali a seguito di un ictus. Resta da dimostrare se i farmaci siano tollerabili, sicuri ed efficaci se assunti in questo modo, ma soluzioni innovative potrebbero comunque affrontare il modo di somministrare quei farmaci.
Un fattore oltre a quelli degli studi clinici falliti è l'interazione degli NMDAR nella sopravvivenza cellulare che può essere completamente fraintesa. Negli ultimi decenni, sono state accumulate prove che gli NMDAR sinaptici possono anche causare la morte cellulare e GluN2A, così come GluN2B, non hanno necessariamente funzioni dicotomiche nell'eccitotossicità. Potrebbero essere necessari ulteriori studi di ricerca per dimostrare strategie più sfumate per gli inibitori dei recettori e per risolvere questa controversia.
Neuroprotettori che prendono di mira la segnalazione di morte cellulare
Un approccio terapeutico per gli inibitori NMDAR consiste nel concentrarsi sugli eventi più a valle della morte cellulare che si verificano in un periodo di tempo molto più lungo dopo l'attivazione del recettore. È stata determinata una varietà di percorsi di morte cellulare a seguito dell'attivazione e diversi gruppi hanno fornito prove di principio che questi percorsi possono essere regolati e gestiti con l'utilizzo di peptidi per proteggere in ultima analisi le cellule cerebrali oi neuroni senza effetti collaterali.
La più antica strategia peptidica segnalata e più esplorata negli obiettivi dell'ictus è la morte cellulare mediata dal protossido di azoto (nNOS). NNOS si collega alla proteina postsinaptica 95 (PSD95) che poi si collega alla coda C-terminale della subunità GluN2B. NOS è un enzima attivato dal calcio che attiva lo sviluppo dell'ossido nitrico (NO) e il proprio stato nel complesso recettore che lo associa in prossimità del flusso focalizzato di calcio che entra in GluN2B attivato. In un ictus, l'eccessivo afflusso di calcio attiva nNOS accoppiati a GluN2B. Un peptide di interferenza viene utilizzato per scollegare il complesso e prevenire lo sviluppo di NO. Il peptide, Tat-NR2B9c, è costituito da una sequenza di penetrazione cellulare derivata da Tat dell'HIV-1 che consente il passaggio attraverso la barriera ematoencefalica e le membrane cellulari, collegata a una copia della regione sul GluN2B per PSD95. Il peptide e GluN2B disconnettono PSD95, quindi, disaccoppiando nNOS nei livelli considerevoli di calcio locali senza interrompere la funzione del recettore da diverse vie. L'utilizzo si traduce in una notevole protezione contro i danni tissutali e funzionali senza effetti collaterali in vitro e in vivo dopo una singola dose somministrata prima o dopo l'ischemia in vivo. Il peptide è recentemente riuscito nella sperimentazione clinica di fase II in cui ha ridotto gli infarti iatrogeni durante il trattamento dell'aneurisma intracranico. Questa è la prima volta che uno studio di ricerca ha dimostrato l'efficienza negli esseri umani che mostra anche l'autenticità che il targeting della morte cellulare a valle può essere utile contro le lesioni neuronali eccitotossiche / ischemiche.
Mentre l'utilizzo dei peptidi in un ambiente clinico è sicuro ed efficace, un'efficienza simile è stata ottenuta con farmaci a piccole molecole che agiscono esattamente per lo stesso obiettivo e funzionano come i peptidi in un ambiente di laboratorio. Per imitare Tat-NR2B9c, è stato dimostrato individualmente che due piccole molecole, IC87201 e ZL006, competono nella regione di connessione specifica di GluN2B identica senza influenzare la connessione di PSD95 ad altre proteine. Inoltre, ZL006 imita la neuroprotezione del peptide senza causare notevoli effetti collaterali negativi. Identificando gli obiettivi e le regioni specifiche, gli studi di ricerca possono simulare farmaci a piccole molecole e accelerare la loro scoperta verso l'eccitotossicità e l'ictus.
Altri percorsi specifici per GluN2B sono stati dimostrati in modo simile e si stanno dimostrando promettenti nelle fasi di sviluppo. Uno di questi percorsi che viene attivato dopo l'attivazione di GluN2B è il potenziamento e il reclutamento di GluN2B nella membrana cellulare da parte della protein chinasi 1 associata alla morte (DAPK1). DAPK1 è una proteina che si collega alla calmodulina per attivare l'apoptosi ma è fosforilata in una forma inattiva che è incapace di associare morte cellulare e calmodulina. A seguito dell'eccitotossicità, l'attivazione della calcineurina defosforila e innesca DAPK1, contribuendo alla morte cellulare. Inoltre, il DAPK1 attivo può connettersi e fosforilare la coda C-terminale dei recettori, l'eccitotossicità e la loro funzione, aggravando l'afflusso di calcio. Un peptide di interferenza collegato a Tat che ha la regione di fosforilazione della coda C che è GluN2B è riuscito a bloccare l'interazione di DAPK1 attivo con GluN2B e promuovere l'eccitotossicità. Una volta che il peptide è stato utilizzato nei topi, soprannominato Tat-NR2B-CT, ha migliorato il risultato dopo l'ischemia. Tuttavia, Tat-NR2B-CT era efficace solo nel prevenire l'attività e l'inserimento incontrollato invece dell'apoptosi a valle della segnalazione DAPK1. I ricercatori sono stati anche in grado di collegare e guidare DAPK1 verso i lisosomi includendo una sequenza nella chiusura del peptide di ostacolo per creare un peptide di degradazione. Il risultato è stato un calo grave e temporaneo dei livelli di DAPK1 occupati con una corrispondente diminuzione dell'infarto durante la somministrazione del peptide ore dopo l'ischemia, secondo diversi studi di ricerca.
La chinasi 3 c-Jun N-terminale (JNK) agisce su molte vie ed è un mediatore per la morte cellulare nell'eccitotossicità. La proteina interagente JNK (JIP) collega e impedisce l'attività JNK attraverso un dominio di legame JNK (JBD) che si estende su oltre 20 residui. Quando questi residui sono collegati a Tat come dal peptide interrotto Tat-JBD20, sono in grado di limitare l'attività JNK e prevenire la morte cellulare nei modelli di ictus quando somministrati prima o dopo l'ischemia. È stato anche dimostrato che il peptide Tat-JBD20 utilizza D-amminoacidi invece di L-amminoacidi per resistere alla degradazione da parte delle proteasi endogene. Ciò aumenta enormemente l'emivita del peptide e non influisce negativamente sulla sua affinità di legame e selettività, dimostrando che questa alterazione può essere utilizzata per diversi peptidi di interferenza per aumentare l'efficienza e la biodisponibilità.
Vengono sempre scoperti nuovi obiettivi. Sebbene attualmente non vengano utilizzati nuovi approcci per il trattamento dell'ictus, sono stati compiuti molti progressi prendendo di mira i processi che si verificano durante l'ictus verso la creazione di approcci terapeutici. Con il debutto del raggiungimento di peptidi di degradazione e interruzione che prendono di mira eventi di segnalazione di passaggio specifici per GluN2B, c'è speranza che nuovi trattamenti siano all'orizzonte per problemi di salute che hanno eccitotossicità.

L'eccitotossicità è il meccanismo patologico mediante il quale le cellule cerebrali o i neuroni vengono infine danneggiati o eliminati dall'eccessiva stimolazione dei neurotrasmettitori, tra cui il glutammato e altre sostanze simili. Ciò si verifica in definitiva quando il recettore NMDA e il recettore AMPA sono iperattivati dai recettori del glutammato neurotrasmettitore eccitatorio. Ciò può causare una varietà di processi che possono danneggiare le strutture cellulari, compresi i componenti del citoscheletro, della membrana e del DNA. Regolamentare e gestire l'eccitotossicità può aiutare a mantenere il benessere generale. - Dr. Alex Jimenez DC, CCST Insight
L'eccitotossicità è un meccanismo patologico in cui un'eccitazione sinaptica eccessiva provoca la morte neuronale e si ritiene anche sia causata dall'accumulo extracellulare del neurotrasmettitore eccitatorio glutammato, che innesca e collega i recettori glutamatergici ionotropici N-metil-D-aspartato nel cervello (NMDAR) . Questo meccanismo patologico è stato suggerito in una varietà di problemi di salute, come la lesione cerebrale traumatica (TBI) e la malattia di Alzheimer (AD), dove è ampiamente esaminato per comprendere i problemi di salute e gli approcci terapeutici. Lo scopo delle nostre informazioni è limitato a problemi di chiropratica, salute muscoloscheletrica e nervosa, nonché articoli, argomenti e discussioni di medicina funzionale. Per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere al Dr. Alex Jimenez o contattarci al numero 915-850-0900 .
A cura del Dr. Alex Jimenez
Riferimenti ï ¿½
- Li, Victor e Yu Tian Wang. Meccanismi molecolari dell'eccitotossicità mediata dal recettore NMDA: implicazioni per le terapie neuroprotettive per l'ictus. Ricerca sulla rigenerazione neuronale, Medknow Publications & Media Pvt Ltd, novembre 2016, www.ncbi.nlm.nih.gov/pmc/articles/PMC5204222/.
Discussione argomento aggiuntiva: dolore cronico
Il dolore improvviso è una risposta naturale del sistema nervoso che aiuta a dimostrare possibili lesioni. Ad esempio, i segnali del dolore viaggiano da una regione lesa attraverso i nervi e il midollo spinale al cervello. Il dolore è generalmente meno grave poiché la lesione guarisce, tuttavia, il dolore cronico è diverso dal tipo medio di dolore. Con dolore cronico, il corpo umano continuerà a inviare segnali di dolore al cervello, indipendentemente dal fatto che la lesione sia guarita. Il dolore cronico può durare da alcune settimane a persino diversi anni. Il dolore cronico può influenzare enormemente la mobilità di un paziente e può ridurre la flessibilità, la forza e la resistenza.
Zoomer Plus neuronale per la malattia neurologica
Il dottor Alex Jimenez utilizza una serie di test per aiutare a valutare le malattie neurologiche. Lo zoom neuraleTM Plus è una gamma di autoanticorpi neurologici che offre un riconoscimento specifico anticorpo-antigene. Il vibrante Neural ZoomerTM Plus è progettato per valutare la reattività di un individuo a 48 antigeni neurologici con connessioni a una varietà di malattie neurologicamente correlate. Il vibrante zoomer neuraleTM Plus mira a ridurre le condizioni neurologiche fornendo ai pazienti e ai medici una risorsa vitale per la diagnosi precoce del rischio e una maggiore attenzione alla prevenzione primaria personalizzata.
Formule per il supporto alla metilazione
XYMOGEN s Le formule professionali esclusive sono disponibili tramite professionisti sanitari selezionati. La vendita e lo sconto su Internet delle formule XYMOGEN sono severamente vietati.
Orgogliosamente, Il dottor Alexander Jimenez rende le formule XYMOGEN disponibili solo per i pazienti sotto la nostra cura.
Si prega di chiamare il nostro ufficio in modo da poter assegnare una consulenza medica per l'accesso immediato.
Se sei un paziente di Injury Medical & Chiropractic Clinica, puoi chiedere informazioni su XYMOGEN chiamando 915-850-0900.
Per vostra comodità e revisione del XYMOGEN prodotti si prega di rivedere il seguente link. *XYMOGEN-Catalog-Scaricare ï ¿½
* Tutte le precedenti politiche XYMOGEN rimangono rigorosamente in vigore.
ï ¿½
Le informazioni qui riportate su "Eccitotossicità NMDA in neurologia funzionale" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale