Riepilogo epigenetico:
L'aumento della prevalenza dell'obesità e delle relative comorbidità è un grave problema di sanità pubblica. Mentre i fattori genetici hanno indubbiamente un ruolo nel determinare la sensibilità individuale all'aumento del peso e all'obesità, le varianti genetiche identificate spiegano solo una parte della variazione. Ciò ha portato ad un crescente interesse per comprendere il ruolo potenziale dell'epigenetica come mediatore di interazioni gene-ambiente che sottendono lo sviluppo dell'obesità e delle relative comorbidità. Le prove iniziali a sostegno di un ruolo di epigenetica nell'obesità e nel diabete mellito di tipo 2 (T2DM) sono state fornite principalmente da studi sugli animali che hanno riportato cambiamenti epigenetici nei tessuti chiave metabolicamente importanti dopo l'alimentazione ad alto contenuto di grassi e differenze epigenetiche tra animali magri e obesi e studi umani che hanno mostrato cambiamenti epigenetici nell'obesità e nei geni candidati T2DM in individui obesi / diabetici. Più di recente, i progressi nelle metodologie epigenetiche e il costo ridotto degli studi sull'associazione di epigenomi (EWAS) hanno portato ad una rapida espansione degli studi nelle popolazioni umane. Questi studi hanno inoltre riportato differenze epigenetiche tra adulti obesi / T2DM e controlli sani e cambiamenti epigenetici in associazione con interventi di nutrizione, perdita di peso e di esercizio. C'è anche una maggiore evidenza da studi sia umani che animali che il rapporto tra le esposizioni nutrizionali perinatali e il rischio successivo di obesità e T2DM può essere mediato da cambiamenti epigenetici nella prole. L'obiettivo di questo riesame è quello di riassumere gli sviluppi più recenti in questo campo in rapida evoluzione, con particolare riguardo all'EWAS umano e studi sull'influenza dei fattori nutrizionali e di stile di vita (sia pre- che postnatal) sull'epigenoma e sul loro rapporto con i metabolici risultati di salute. Si affrontano anche le difficoltà di distinguere le conseguenze dalla causalità in questi studi e il ruolo critico dei modelli animali per la sperimentazione di rapporti causali e fornire approfondimenti sui meccanismi sottostanti. In sintesi, l'area dell'epigenetica e della salute metabolica ha visto sviluppi rapidi in un breve lasso di tempo. Mentre i risultati finora sono promettenti, gli studi sono in corso e il prossimo decennio promette di essere un momento di ricerca produttiva sulle complesse interazioni tra il genoma, l'epigenoma e l'ambiente in quanto riguardano la malattia metabolica.
parole chiave: Epigenetica, metilazione del DNA, obesità, diabete di tipo 2, programmazione dello sviluppo
Contenuti
Introduzione
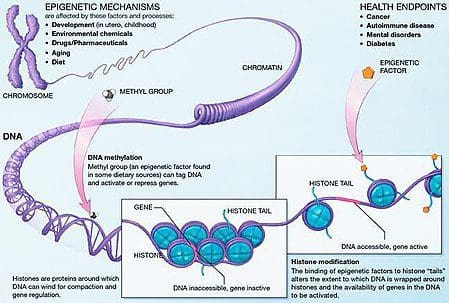 L'obesità è una malattia complessa e multifattoriale e una migliore comprensione dei meccanismi che sottendono le interazioni tra stile di vita, ambiente e genetica è fondamentale per lo sviluppo di strategie efficaci per la prevenzione e il trattamento [1].
L'obesità è una malattia complessa e multifattoriale e una migliore comprensione dei meccanismi che sottendono le interazioni tra stile di vita, ambiente e genetica è fondamentale per lo sviluppo di strategie efficaci per la prevenzione e il trattamento [1].
In una società in cui il cibo denso di energia è abbondante e la necessità di attività fisica è bassa, vi è un'ampia variazione nella suscettibilità degli individui a sviluppare obesità e problemi di salute metabolica. Le stime del ruolo dell'ereditarietà in questa variazione sono comprese tra il 40 e il 70% e, sebbene ampi studi di associazione sull'intero genoma (GWAS) abbiano identificato una serie di loci genetici associati al rischio di obesità, solo le ~ 100 varianti genetiche più comuni rappresentano una piccola percentuale della varianza nell'obesità [2, 3]. Le stime a livello di genoma sono più elevate, rappresentando circa il 20% della variazione [3]; tuttavia, gran parte dell'ereditabilità rimane inspiegabile.
Recentemente, l'attenzione si è rivolta allo studio del ruolo dei cambiamenti epigenetici nell'eziologia dell'obesità. È stato affermato che l'epigenoma può rappresentare il legame meccanicistico tra varianti genetiche e fattori ambientali nel determinare il rischio di obesità e potrebbe aiutare a spiegare la `` ereditabilità mancante ''. I primi studi epigenetici sull'uomo erano piccoli e studiavano solo un numero limitato di loci. Sebbene ciò abbia generalmente portato a una scarsa riproducibilità, alcuni di questi primi risultati, ad esempio la relazione tra metilazione PGC1A e diabete mellito di tipo 2 (T2DM) [4] e altri discussi in van Dijk et al. [5], sono stati replicati in studi successivi. I recenti progressi e la maggiore convenienza delle tecnologie ad alto rendimento ora consentono studi di associazione su larga scala dell'epigenoma (EWAS) e l'integrazione di diversi strati di informazioni genomiche per esplorare le complesse interazioni tra genotipo, epigenoma, trascrittoma e ambiente [6 9]. Questi studi sono ancora agli inizi, ma i risultati finora hanno mostrato risultati promettenti nell'aiutare a spiegare la variazione della suscettibilità all'obesità.
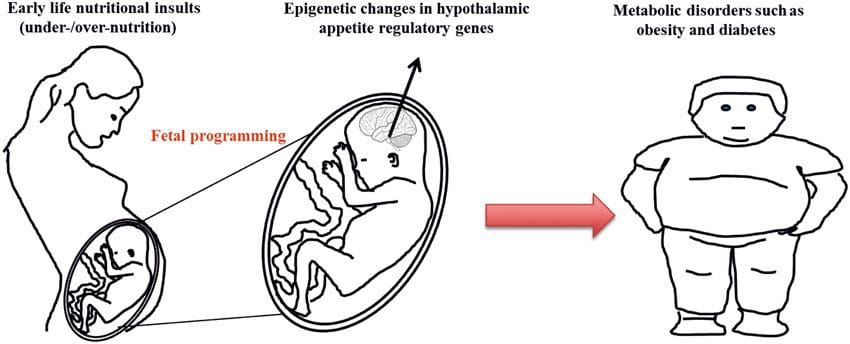
Vi sono prove crescenti che l'obesità abbia sviluppato origini mentali, poiché l'esposizione a un apporto di nutrienti non ottimale prima della nascita o nella prima infanzia è associata ad un aumentato rischio di obesità e malattie metaboliche in età avanzata [10-13]. Inizialmente, studi sugli animali hanno dimostrato che una serie di esposizioni nutrizionali nella prima infanzia, in particolare quelle sperimentate all'inizio della gestazione, potrebbe indurre cambiamenti epigenetici nei tessuti metabolici chiave della prole che persistevano dopo la nascita e provocare alterazioni permanenti della funzione genica [13-17]. Stanno emergendo prove a sostegno dell'esistenza dello stesso meccanismo negli esseri umani. Ciò ha portato a una ricerca di segni epigenetici presenti all'inizio della vita che predicono il successivo rischio di malattia metabolica e studi per determinare se la programmazione epigenetica della malattia metabolica possa essere prevenuta o invertita in età avanzata.
Questa recensione fornisce un aggiornamento della nostra precedente revisione sistematica degli studi sull'epigenetica e l'obesità nell'uomo [5]. La nostra recensione precedente ha mostrato i risultati promettenti degli studi iniziali, inclusi i primi segni epigenetici potenziali per l'obesità che potrebbero essere rilevati alla nascita (ad esempio, RXRA) [18]. Tuttavia, ha anche evidenziato la limitata riproducibilità dei risultati e la mancanza di indagini longitudinali su larga scala. L'attuale rassegna si concentra sui recenti sviluppi in questo campo in rapida evoluzione e, in particolare, sull'EWAS umano e sugli studi sull'influenza dei fattori nutrizionali e di vita (pre- e postnatali) sull'epigenoma e sul ruolo emergente dell'epigenetica nella patologia dell'obesità . Inoltre affrontiamo le difficoltà nell'individuazione della causalità in questi studi e l'importanza dei modelli animali per fornire approfondimenti sui meccanismi.
Review
Cambiamenti epigenetici nei modelli animali dell'obesità
 I modelli animali offrono opportunità uniche per studi altamente controllati che forniscono informazioni meccanicistiche sul ruolo di specifici segni epigenetici, sia come indicatori dell'attuale stato metabolico che come predittori del futuro rischio di obesità e malattie metaboliche. Un aspetto particolarmente importante degli studi sugli animali è che consentono la valutazione dei cambiamenti epigenetici all'interno dei tessuti bersaglio, inclusi il fegato e l'ipotalamo, che è molto più difficile negli esseri umani. Inoltre, la capacità di raccogliere grandi quantità di tessuto fresco consente di valutare più segni di cromatina così come la metilazione del DNA. Alcune di queste modificazioni epigenetiche, da sole o in combinazione, possono rispondere alla programmazione ambientale. Nei modelli animali, è anche possibile studiare più generazioni di prole e quindi consentire la differenziazione tra trasmissione transgenerazionale e intergenerazionale del rischio di obesità mediata dalla memoria epigenetica dello stato nutrizionale dei genitori, che non può essere facilmente distinta negli studi sull'uomo. Usiamo il primo termine per la trasmissione meiotica del rischio in assenza di esposizione continua, mentre il secondo implica principalmente la trasmissione diretta del rischio attraverso la riprogrammazione metabolica del feto o dei gameti.
I modelli animali offrono opportunità uniche per studi altamente controllati che forniscono informazioni meccanicistiche sul ruolo di specifici segni epigenetici, sia come indicatori dell'attuale stato metabolico che come predittori del futuro rischio di obesità e malattie metaboliche. Un aspetto particolarmente importante degli studi sugli animali è che consentono la valutazione dei cambiamenti epigenetici all'interno dei tessuti bersaglio, inclusi il fegato e l'ipotalamo, che è molto più difficile negli esseri umani. Inoltre, la capacità di raccogliere grandi quantità di tessuto fresco consente di valutare più segni di cromatina così come la metilazione del DNA. Alcune di queste modificazioni epigenetiche, da sole o in combinazione, possono rispondere alla programmazione ambientale. Nei modelli animali, è anche possibile studiare più generazioni di prole e quindi consentire la differenziazione tra trasmissione transgenerazionale e intergenerazionale del rischio di obesità mediata dalla memoria epigenetica dello stato nutrizionale dei genitori, che non può essere facilmente distinta negli studi sull'uomo. Usiamo il primo termine per la trasmissione meiotica del rischio in assenza di esposizione continua, mentre il secondo implica principalmente la trasmissione diretta del rischio attraverso la riprogrammazione metabolica del feto o dei gameti.
Gli studi sugli animali hanno svolto un ruolo fondamentale nella nostra attuale comprensione del ruolo dell'epigenetica nelle origini evolutive dell'obesità e del T2DM. Sia l'aumento che la diminuzione della nutrizione materna durante la gravidanza sono stati associati ad un aumento della deposizione di grasso nella prole della maggior parte delle specie di mammiferi studiate fino ad oggi (rivisto in [11, 13-15, 19]). La nutrizione materna durante la gravidanza non solo ha potenziali effetti diretti sul feto, ma può anche avere un impatto diretto sullo sviluppo di ovociti di feti femmine e cellule germinali primordiali di feti maschi e quindi potrebbe avere un impatto sia sulla prole che sulla nonnina. Pertanto, i dati multigenerazionali sono solitamente necessari per distinguere tra meccanismi di trasmissione intergenerazionale materna e transgenerazionale.
Tabella 1 sintetizza una varietà di modelli animali che sono stati utilizzati per fornire evidenza di cambiamenti metabolici e epigenetici nei figli associati al piano parentale della nutrizione. Inoltre contiene informazioni relative a studi che identificano alterati marcature epigenetici in soggetti adulti che subiscono sfide nutrizionali dirette. La tabella è strutturata dal tipo di trasmissione del rischio suggerito.
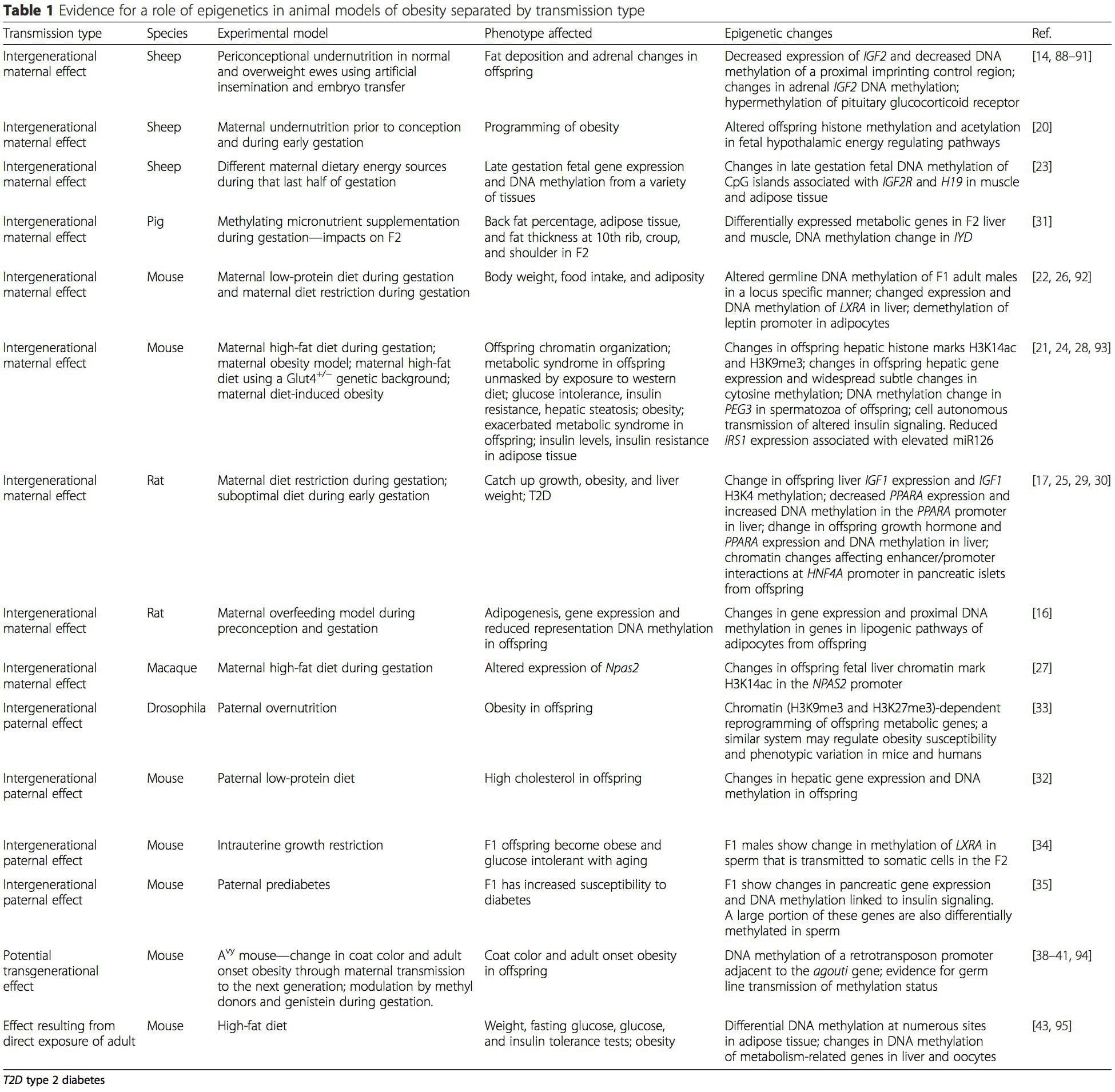 i) Cambiamenti epigenetici nella prole associata all'alimentazione materna durante la gestazione
i) Cambiamenti epigenetici nella prole associata all'alimentazione materna durante la gestazione
 L'integrazione nutrizionale materna, la denutrizione e la sovralimentazione durante la gravidanza possono alterare la deposizione di grasso e l'omeostasi energetica nella prole [11, 13-15, 19]. Associati a questi effetti nella prole sono i cambiamenti nella metilazione del DNA, le modificazioni post-traduzionali degli istoni e l'espressione genica per diversi geni bersaglio, specialmente i geni che regolano il metabolismo degli acidi grassi e la segnalazione dell'insulina [16, 17, 20-30]. La diversità dei modelli animali utilizzati in questi studi e le vie metaboliche comuni influenzate suggeriscono una risposta adattativa conservata dal punto di vista evolutivo mediata dalla modificazione epigenetica. Tuttavia, alcuni dei geni specifici identificati e dei cambiamenti epigenetici sono stati convalidati in modo incrociato in studi correlati e le indagini su larga scala a livello di genoma in genere non sono state applicate. Uno dei principali ostacoli al confronto di questi studi è rappresentato dalle diverse finestre mentali di sviluppo soggette a sfide nutrizionali, che possono causare risultati notevolmente diversi. È anche richiesta la prova che i cambiamenti epigenetici sono causali piuttosto che essere associati a cambiamenti fenotipici della prole. Ciò richiederà l'identificazione di una risposta epigenetica `` memoria '' nutrizionalmente indotta dai genitori che precede lo sviluppo del fenotipo alterato nella prole.
L'integrazione nutrizionale materna, la denutrizione e la sovralimentazione durante la gravidanza possono alterare la deposizione di grasso e l'omeostasi energetica nella prole [11, 13-15, 19]. Associati a questi effetti nella prole sono i cambiamenti nella metilazione del DNA, le modificazioni post-traduzionali degli istoni e l'espressione genica per diversi geni bersaglio, specialmente i geni che regolano il metabolismo degli acidi grassi e la segnalazione dell'insulina [16, 17, 20-30]. La diversità dei modelli animali utilizzati in questi studi e le vie metaboliche comuni influenzate suggeriscono una risposta adattativa conservata dal punto di vista evolutivo mediata dalla modificazione epigenetica. Tuttavia, alcuni dei geni specifici identificati e dei cambiamenti epigenetici sono stati convalidati in modo incrociato in studi correlati e le indagini su larga scala a livello di genoma in genere non sono state applicate. Uno dei principali ostacoli al confronto di questi studi è rappresentato dalle diverse finestre mentali di sviluppo soggette a sfide nutrizionali, che possono causare risultati notevolmente diversi. È anche richiesta la prova che i cambiamenti epigenetici sono causali piuttosto che essere associati a cambiamenti fenotipici della prole. Ciò richiederà l'identificazione di una risposta epigenetica `` memoria '' nutrizionalmente indotta dai genitori che precede lo sviluppo del fenotipo alterato nella prole.
(ii) Effetti dell'alimentazione paterna sui segni epigenetici della prole
 Studi emergenti hanno dimostrato che il piano nutrizionale paterno può influire sulla deposizione di grasso della prole e sui segni epigenetici [31-34]. Una recente indagine su topi ha dimostrato che il pre-diabete paterno porta ad una maggiore suscettibilità al diabete nella prole F1 con cambiamenti associati nell'espressione genica pancreatica e metilazione del DNA legata alla segnalazione dell'insulina [35]. È importante sottolineare che c'era una sovrapposizione di questi cambiamenti epigenetici nelle isole pancreatiche e negli spermatozoi che suggerivano l'ereditarietà della linea germinale. Tuttavia, la maggior parte di questi studi, sebbene intriganti nelle loro implicazioni, sono limitati nella scala genomica di indagine e mostrano frequentemente alterazioni epigenetiche deboli e alquanto transitorie associate a fenotipi metabolici lievi nella prole.
Studi emergenti hanno dimostrato che il piano nutrizionale paterno può influire sulla deposizione di grasso della prole e sui segni epigenetici [31-34]. Una recente indagine su topi ha dimostrato che il pre-diabete paterno porta ad una maggiore suscettibilità al diabete nella prole F1 con cambiamenti associati nell'espressione genica pancreatica e metilazione del DNA legata alla segnalazione dell'insulina [35]. È importante sottolineare che c'era una sovrapposizione di questi cambiamenti epigenetici nelle isole pancreatiche e negli spermatozoi che suggerivano l'ereditarietà della linea germinale. Tuttavia, la maggior parte di questi studi, sebbene intriganti nelle loro implicazioni, sono limitati nella scala genomica di indagine e mostrano frequentemente alterazioni epigenetiche deboli e alquanto transitorie associate a fenotipi metabolici lievi nella prole.
(iii) Potenziali cambiamenti epigenetici transgenerazionali che promuovono la deposizione di grassi nella prole
 La trasmissione stabile di informazioni epigenetiche tra più generazioni è ben descritta nei sistemi vegetali e in C. elegans, ma il suo significato nei mammiferi è ancora molto dibattuto [36, 37]. Una base epigenetica per la trasmissione non genitoriale dei fenotipi in risposta alle esposizioni alimentari è stata ben stabilita, anche nelle specie di bestiame [31]. Gli studi più influenti che dimostrano gli effetti della trasmissione epigenetica sul fenotipo della prole hanno utilizzato l'esempio del topo agouti giallo (Avy) vitale [38]. In questo topo, l'inserimento di un retrotrasposone a monte del gene agouti provoca la sua espressione costitutiva e il conseguente colore del mantello giallo e l'obesità ad esordio nell'adulto. La trasmissione materna attraverso la linea germinale si traduce in un silenziamento mediato dalla metilazione del DNA dell'espressione di agouti con conseguente colore del mantello wild-type e fenotipo magro della prole [39, 40]. È importante sottolineare che studi successivi su questi topi hanno dimostrato che l'esposizione materna a donatori di metile provoca un cambiamento nel colore del mantello [41]. Uno studio ha riportato la trasmissione di un fenotipo alla generazione F3 e alterazioni nell'espressione di un gran numero di geni in risposta alla restrizione proteica in F0 [42]; tuttavia, le alterazioni nell'espressione erano altamente variabili e un collegamento diretto ai cambiamenti epigenetici non è stato identificato in questo sistema.
La trasmissione stabile di informazioni epigenetiche tra più generazioni è ben descritta nei sistemi vegetali e in C. elegans, ma il suo significato nei mammiferi è ancora molto dibattuto [36, 37]. Una base epigenetica per la trasmissione non genitoriale dei fenotipi in risposta alle esposizioni alimentari è stata ben stabilita, anche nelle specie di bestiame [31]. Gli studi più influenti che dimostrano gli effetti della trasmissione epigenetica sul fenotipo della prole hanno utilizzato l'esempio del topo agouti giallo (Avy) vitale [38]. In questo topo, l'inserimento di un retrotrasposone a monte del gene agouti provoca la sua espressione costitutiva e il conseguente colore del mantello giallo e l'obesità ad esordio nell'adulto. La trasmissione materna attraverso la linea germinale si traduce in un silenziamento mediato dalla metilazione del DNA dell'espressione di agouti con conseguente colore del mantello wild-type e fenotipo magro della prole [39, 40]. È importante sottolineare che studi successivi su questi topi hanno dimostrato che l'esposizione materna a donatori di metile provoca un cambiamento nel colore del mantello [41]. Uno studio ha riportato la trasmissione di un fenotipo alla generazione F3 e alterazioni nell'espressione di un gran numero di geni in risposta alla restrizione proteica in F0 [42]; tuttavia, le alterazioni nell'espressione erano altamente variabili e un collegamento diretto ai cambiamenti epigenetici non è stato identificato in questo sistema.
(iv) Esposizione diretta di individui ad un'alimentazione in eccesso nella vita postnatale
 Mentre molti studi hanno individuato cambiamenti epigenetici associati alla dieta nei modelli animali che utilizzano aree candidate specifiche del sito, sono state eseguite alcune analisi genomiche. Un recente studio si è concentrato sulla determinazione dell'impatto epigenetico diretto delle diete ad alto tenore di grassi / obesità indotta dalla dieta nei topi adulti utilizzando l'espressione genica di genoma e le analisi della metilazione del DNA [43]. Questo studio ha individuato le regioni 232 differenzialmente metilate (DMR) in adipociti dal controllo e dai topi alimentati ad alto contenuto di grassi. Importante, le regioni umane corrispondenti per i DMR murine sono state anche differenzialmente metilate nei tessuti adiposi da una popolazione di persone obese e magre, evidenziando così la notevole conservazione evolutiva di queste regioni. Questo risultato sottolinea la probabile importanza dei DMR identificati nella regolazione dell'omeostasi di energia nei mammiferi.
Mentre molti studi hanno individuato cambiamenti epigenetici associati alla dieta nei modelli animali che utilizzano aree candidate specifiche del sito, sono state eseguite alcune analisi genomiche. Un recente studio si è concentrato sulla determinazione dell'impatto epigenetico diretto delle diete ad alto tenore di grassi / obesità indotta dalla dieta nei topi adulti utilizzando l'espressione genica di genoma e le analisi della metilazione del DNA [43]. Questo studio ha individuato le regioni 232 differenzialmente metilate (DMR) in adipociti dal controllo e dai topi alimentati ad alto contenuto di grassi. Importante, le regioni umane corrispondenti per i DMR murine sono state anche differenzialmente metilate nei tessuti adiposi da una popolazione di persone obese e magre, evidenziando così la notevole conservazione evolutiva di queste regioni. Questo risultato sottolinea la probabile importanza dei DMR identificati nella regolazione dell'omeostasi di energia nei mammiferi.
Studi umani
Sfruttando le prove degli studi sugli animali e con la crescente disponibilità di strumenti accessibili per l'analisi genoma, si è registrata una rapida espansione degli studi epigenomi negli esseri umani. Questi studi si sono concentrati principalmente sull'identificazione delle differenze specifiche del sito nella metilazione del DNA associate a fenotipi metabolici.
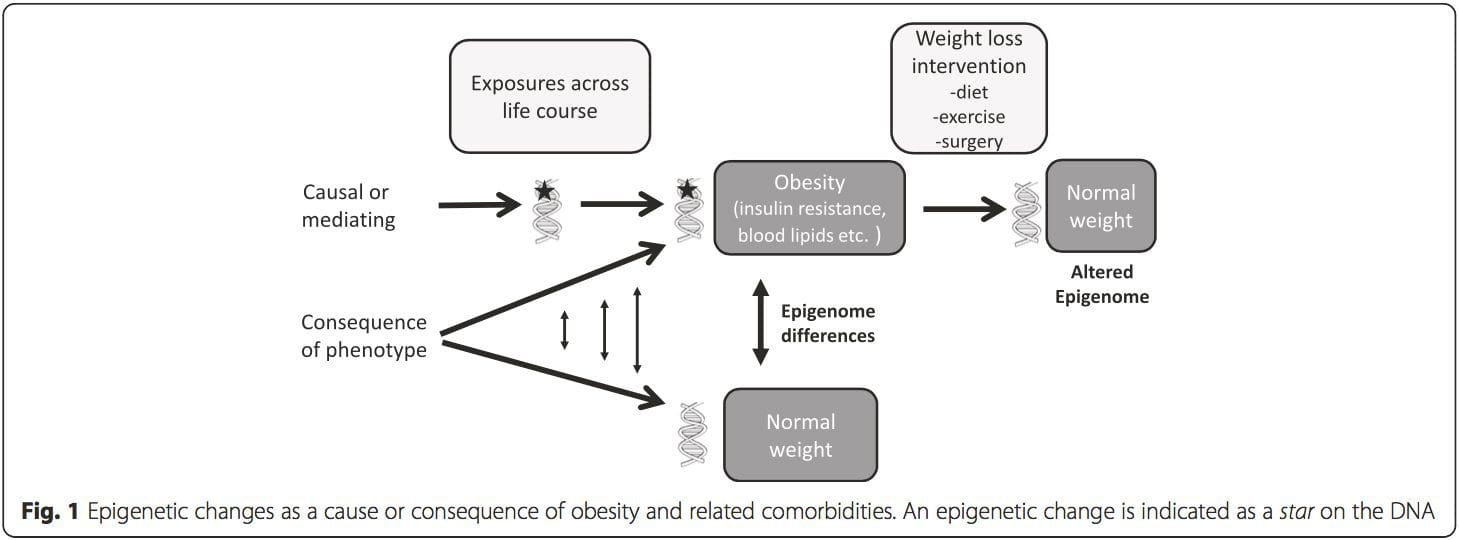
Una questione fondamentale è la misura in cui le modificazioni epigenetiche contribuiscono allo sviluppo del fenotipo metabolico piuttosto che semplicemente essere una sequenza di esso (Fig. 1). La programmazione epigenetica potrebbe contribuire allo sviluppo dell'obesità, oltre a svolgere un ruolo in conseguente rischio di problemi cardiovascolari e metabolici. Negli studi umani è difficile dimostrare la causalità [44], ma si possono fare inferenze da una serie di linee di prova:
 (i) Studi di associazione genetica. I polimorfismi genetici che sono associati ad un aumentato rischio di sviluppare particolari condizioni sono a priori legati ai geni causali. La presenza di metilazione differenziale in tali regioni inferisce la rilevanza funzionale di questi cambiamenti epigenetici nel controllo dell'espressione dei geni prossimali. Esistono forti effetti genetici ad azione cis alla base di molte variazioni epigenetiche [7, 45] e negli studi basati sulla popolazione sono stati applicati metodi che utilizzano surrogati genetici per inferire un ruolo causale o mediatore delle differenze epigenomiche [7, 46-48] . L'uso di informazioni genetiche familiari può anche portare all'identificazione di regioni candidate potenzialmente causali che mostrano una metilazione differenziale correlata al fenotipo [49].
(i) Studi di associazione genetica. I polimorfismi genetici che sono associati ad un aumentato rischio di sviluppare particolari condizioni sono a priori legati ai geni causali. La presenza di metilazione differenziale in tali regioni inferisce la rilevanza funzionale di questi cambiamenti epigenetici nel controllo dell'espressione dei geni prossimali. Esistono forti effetti genetici ad azione cis alla base di molte variazioni epigenetiche [7, 45] e negli studi basati sulla popolazione sono stati applicati metodi che utilizzano surrogati genetici per inferire un ruolo causale o mediatore delle differenze epigenomiche [7, 46-48] . L'uso di informazioni genetiche familiari può anche portare all'identificazione di regioni candidate potenzialmente causali che mostrano una metilazione differenziale correlata al fenotipo [49].
(ii) Timing dei cambiamenti epigenetici. La presenza di un marchio epigenetico prima dello sviluppo di un fenotipo è una caratteristica essenziale associata alla causalità. Al contrario, la presenza di un marchio in associazione con l'obesità, ma non prima del suo sviluppo, può essere usata per escludere la causalità, ma non escludere un possibile ruolo nella patologia successiva dell'obesità.
(iii) Conclusione plausibile del meccanismo. Ciò si riferisce ai cambiamenti epigenetici associati all'espressione alterata di geni con un ruolo determinato nella regolazione del fenotipo di interesse. Un esempio di questo tipo è l'associazione della metilazione a due siti CpG del gene CPT1A con livelli di trigliceridi circolanti [50]. CPT1A codifica la carnitina palmitoyltransferase 1A, un enzima che ha un ruolo centrale nel metabolismo degli acidi grassi e questo è fortemente indicativo che la metilazione differenziale di questo gene può essere causale correlata alle alterazioni delle concentrazioni plasmatiche di trigliceridi.
Studi sull'associazione di epigenomi: Identificazione dei biomarker epigenetici della salute metabolica
Numerose indagini recenti si sono concentrate sull'esplorazione delle associazioni tra obesità / malattie metaboliche e metilazione del DNA attraverso il genoma (Tabella 2). Il più grande EWAS pubblicato finora, comprendente un totale di 5465 individui, ha identificato 37 siti di metilazione nel sangue associati all'indice di massa corporea (BMI), inclusi i siti in CPT1A, ABCG1 e SREBF1 [51]. Un altro studio su larga scala ha mostrato associazioni coerenti tra BMI e metilazione in HIF3A nel sangue intero e nel tessuto adiposo [52], una scoperta che è stata anche parzialmente replicata in altri studi [9, 51]. Altre associazioni recentemente segnalate tra misure correlate all'obesità e metilazione del DNA includono (i) differenze di metilazione del DNA tra magra e obeso individui in LY86 nei leucociti del sangue [53]; (ii) associazioni tra metilazione del promotore PGC1A nel sangue intero di bambini e adiposità 5 anni dopo [54]; (iii) associazioni tra rapporto vita-fianchi e metilazione di ADRB3 nel sangue [55]; e (iv) associazioni tra BMI, misure di distribuzione del grasso corporeo e più siti di metilazione del DNA nel tessuto adiposo [9, 56]. EWAS ha anche mostrato associazioni tra siti di metilazione del DNA e lipidi nel sangue [55, 57-59], metaboliti sierici [60], resistenza all'insulina [9, 61] e T2DM [48, 62, 63] (Tabella 2).
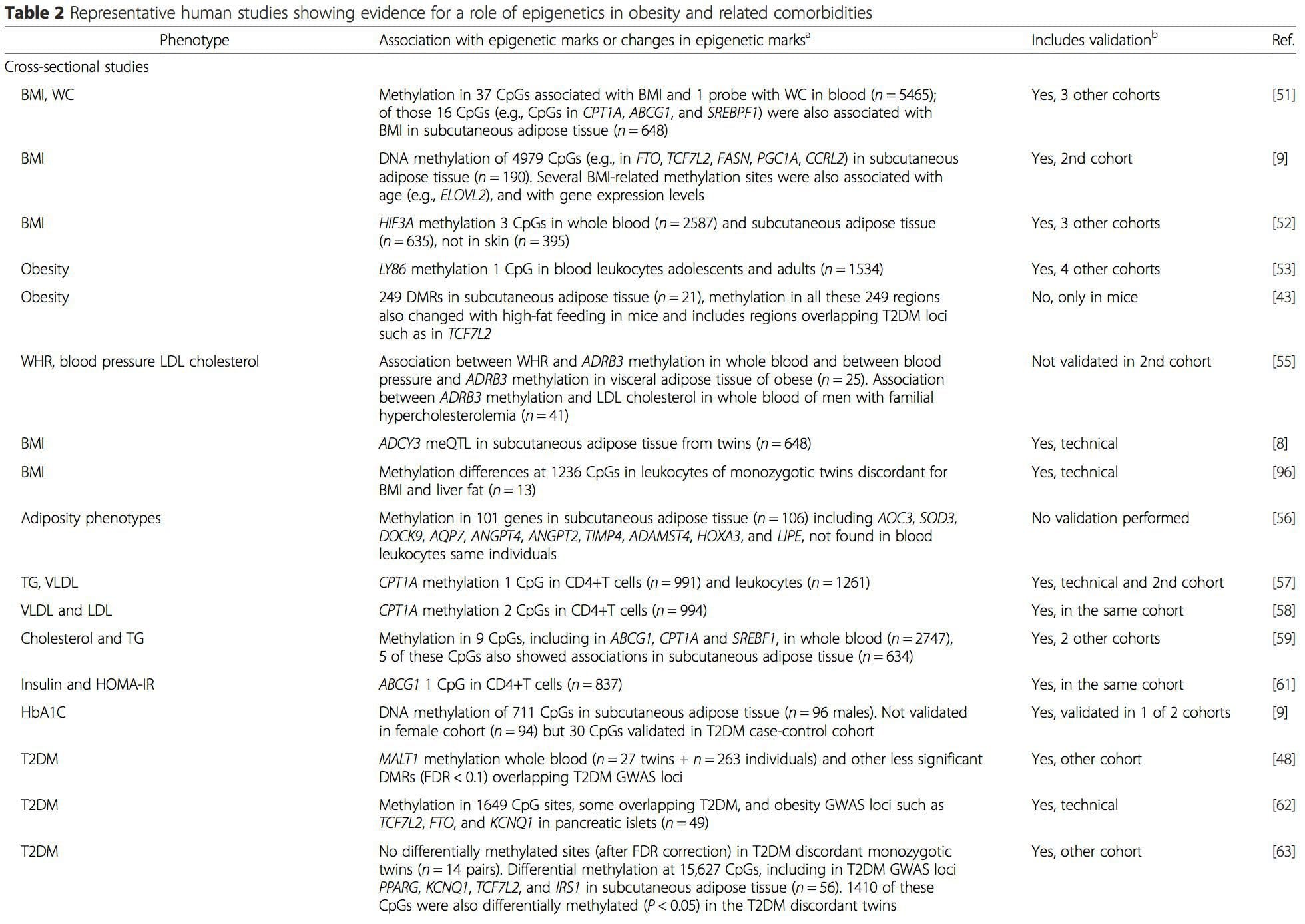
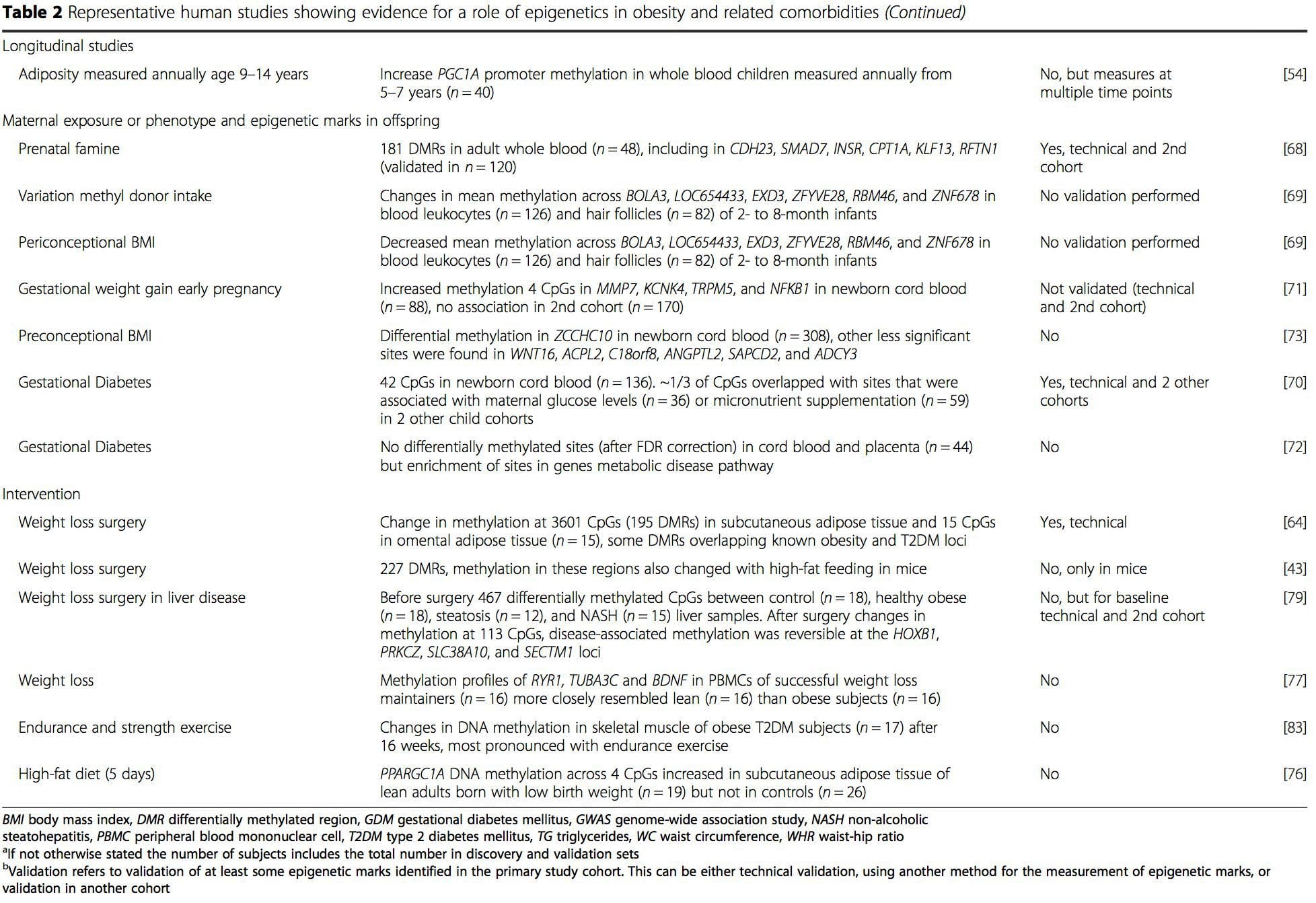 Da questi studi, la metilazione alterata di PGC1A, HIF3A, ABCG1 e CPT1A e la RXRA [18] descritta in precedenza sono emerse come biomarcatori associati, o forse predittivi, alla salute metabolica che sono anche candidati plausibili per un ruolo nello sviluppo della malattia metabolica .
Da questi studi, la metilazione alterata di PGC1A, HIF3A, ABCG1 e CPT1A e la RXRA [18] descritta in precedenza sono emerse come biomarcatori associati, o forse predittivi, alla salute metabolica che sono anche candidati plausibili per un ruolo nello sviluppo della malattia metabolica .
Interazione tra il genotipo e l'epigenoma
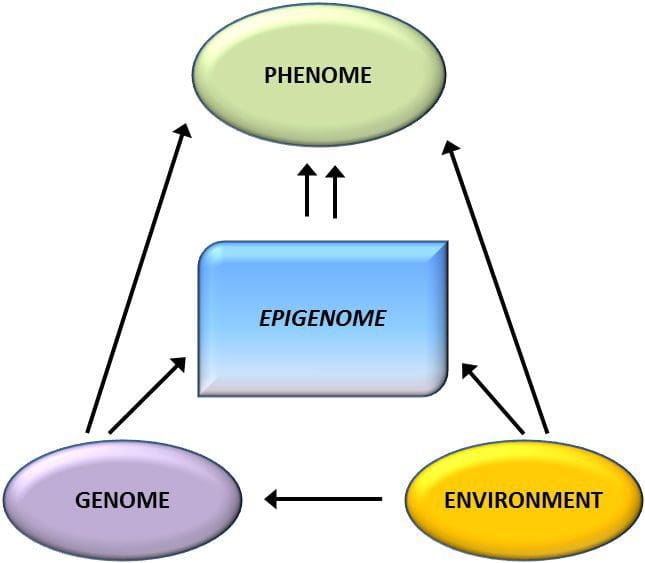 La variazione epigenetica è fortemente influenzata dalla variazione genetica sottostante, con il genotipo stimato per spiegare ~ 20-40% della variazione [6, 8]. Recentemente, una serie di studi ha iniziato a integrare i dati del metiloma e del genotipo per identificare i loci dei tratti quantitativi di metilazione (meQTL) associati ai fenotipi della malattia. Ad esempio, nel tessuto adiposo, è stata identificata una sovrapposizione meQTL con un locus di rischio genetico BMI in un elemento potenziatore a monte di ADCY3 [8]. Altri studi hanno anche identificato sovrapposizioni tra obesità nota e loci di rischio T2DM e DMR associati all'obesità e T2DM [43, 48, 62]. La metilazione di un certo numero di tali DMR è stata modulata anche dall'alimentazione ad alto contenuto di grassi nei topi [43] e dalla perdita di peso negli esseri umani [64]. Questi risultati identificano un legame intrigante tra le variazioni genetiche legate alla suscettibilità alla malattia e la loro associazione con regioni del genoma che subiscono modificazioni epigenetiche in risposta a sfide nutrizionali, implicando una relazione causale. La stretta connessione tra variazione genetica ed epigenetica può significare i loro ruoli essenziali nella generazione della variazione individuale [65, 66]. Tuttavia, mentre questi risultati suggeriscono che la metilazione del DNA può essere un mediatore di effetti genetici, è anche importante considerare che i processi genetici ed epigenetici potrebbero agire indipendentemente sugli stessi geni. Studi sui gemelli [8, 63, 67] possono fornire importanti intuizioni e indicare che le differenze interindividuali nei livelli di metilazione del DNA derivano prevalentemente da ambienti non condivisi e influenze stocastiche, in minima parte da effetti ambientali condivisi, ma anche con un impatto significativo della genetica variazione.
La variazione epigenetica è fortemente influenzata dalla variazione genetica sottostante, con il genotipo stimato per spiegare ~ 20-40% della variazione [6, 8]. Recentemente, una serie di studi ha iniziato a integrare i dati del metiloma e del genotipo per identificare i loci dei tratti quantitativi di metilazione (meQTL) associati ai fenotipi della malattia. Ad esempio, nel tessuto adiposo, è stata identificata una sovrapposizione meQTL con un locus di rischio genetico BMI in un elemento potenziatore a monte di ADCY3 [8]. Altri studi hanno anche identificato sovrapposizioni tra obesità nota e loci di rischio T2DM e DMR associati all'obesità e T2DM [43, 48, 62]. La metilazione di un certo numero di tali DMR è stata modulata anche dall'alimentazione ad alto contenuto di grassi nei topi [43] e dalla perdita di peso negli esseri umani [64]. Questi risultati identificano un legame intrigante tra le variazioni genetiche legate alla suscettibilità alla malattia e la loro associazione con regioni del genoma che subiscono modificazioni epigenetiche in risposta a sfide nutrizionali, implicando una relazione causale. La stretta connessione tra variazione genetica ed epigenetica può significare i loro ruoli essenziali nella generazione della variazione individuale [65, 66]. Tuttavia, mentre questi risultati suggeriscono che la metilazione del DNA può essere un mediatore di effetti genetici, è anche importante considerare che i processi genetici ed epigenetici potrebbero agire indipendentemente sugli stessi geni. Studi sui gemelli [8, 63, 67] possono fornire importanti intuizioni e indicare che le differenze interindividuali nei livelli di metilazione del DNA derivano prevalentemente da ambienti non condivisi e influenze stocastiche, in minima parte da effetti ambientali condivisi, ma anche con un impatto significativo della genetica variazione.
L'impatto dell'ambiente prenatale e postnatale sull'epigenoma
 Ambiente prenatale: Due studi pubblicati di recente hanno fatto uso di popolazioni umane che hanno sperimentato variazioni "naturali" nell'apporto di nutrienti per studiare l'impatto della nutrizione materna prima o durante la gravidanza sulla metilazione del DNA nella prole [68, 69]. Il primo studio ha utilizzato una coorte madre-figlio del Gambia per dimostrare che sia le variazioni stagionali dell'assunzione di donatori di metile materno durante la gravidanza che il BMI materno pre-gravidanza erano associati a metilazione alterata nei neonati [69]. Il secondo studio ha utilizzato la prole adulta della coorte olandese Hunger Winter per studiare l'effetto dell'esposizione prenatale a un periodo acuto di grave denutrizione materna sulla metilazione del DNA dei geni coinvolti nella crescita e nel metabolismo in età adulta [68]. I risultati hanno evidenziato l'importanza della tempistica dell'esposizione nel suo impatto sull'epigenoma, poiché effetti epigenetici significativi sono stati identificati solo in individui esposti alla carestia durante le prime fasi della gestazione. È importante sottolineare che i cambiamenti epigenetici si sono verificati in concomitanza con un aumento del BMI; tuttavia, non è stato possibile stabilire in questo studio se questi cambiamenti fossero presenti in una fase precoce della vita o come conseguenza di un BMI più elevato.
Ambiente prenatale: Due studi pubblicati di recente hanno fatto uso di popolazioni umane che hanno sperimentato variazioni "naturali" nell'apporto di nutrienti per studiare l'impatto della nutrizione materna prima o durante la gravidanza sulla metilazione del DNA nella prole [68, 69]. Il primo studio ha utilizzato una coorte madre-figlio del Gambia per dimostrare che sia le variazioni stagionali dell'assunzione di donatori di metile materno durante la gravidanza che il BMI materno pre-gravidanza erano associati a metilazione alterata nei neonati [69]. Il secondo studio ha utilizzato la prole adulta della coorte olandese Hunger Winter per studiare l'effetto dell'esposizione prenatale a un periodo acuto di grave denutrizione materna sulla metilazione del DNA dei geni coinvolti nella crescita e nel metabolismo in età adulta [68]. I risultati hanno evidenziato l'importanza della tempistica dell'esposizione nel suo impatto sull'epigenoma, poiché effetti epigenetici significativi sono stati identificati solo in individui esposti alla carestia durante le prime fasi della gestazione. È importante sottolineare che i cambiamenti epigenetici si sono verificati in concomitanza con un aumento del BMI; tuttavia, non è stato possibile stabilire in questo studio se questi cambiamenti fossero presenti in una fase precoce della vita o come conseguenza di un BMI più elevato.
Altri studi recenti hanno fornito prove che la sovralimentazione prenatale e un ambiente materno obeso o diabetico sono anche associati a cambiamenti di metilazione del DNA nei geni correlati allo sviluppo embrionale, alla crescita e alle malattie metaboliche nella prole [70-73].
Mentre i dati umani sono scarsi, ci sono indicazioni che l'obesità paterna può portare alla alterazione della metilazione di geni imprintati nel neonato [74], un effetto che si pensa di essere mediato attraverso i cambiamenti epigenetici acquisiti durante la spermatogenesi.
 Ambiente postnatale: L'epigenoma viene stabilito de novo durante lo sviluppo embrionale e quindi l'ambiente prenatale ha molto probabilmente l'impatto più significativo sull'epigenoma. Tuttavia, è ora chiaro che i cambiamenti si verificano nell'epigenoma `` maturo '' sotto l'influenza di una serie di condizioni, tra cui l'invecchiamento, l'esposizione alle tossine e le alterazioni della dieta. Ad esempio, sono stati dimostrati cambiamenti nella metilazione del DNA in numerosi geni nel muscolo scheletrico e PGC1A nel tessuto adiposo in risposta a una dieta ricca di grassi [75, 76]. Anche gli interventi per perdere massa grassa sono stati associati a cambiamenti nella metilazione del DNA. Studi hanno riportato che i profili di metilazione del DNA del tessuto adiposo [43, 64], delle cellule mononucleate del sangue periferico [77] e del tessuto muscolare [78] nei pazienti precedentemente obesi diventano più simili ai profili dei soggetti magri dopo la perdita di peso. La chirurgia per la perdita di peso ha anche parzialmente invertito i cambiamenti di metilazione associati alla steatosi epatica non alcolica nel fegato [79] e in un altro studio ha portato all'ipometilazione di più geni candidati all'obesità, con effetti più pronunciati nel sottocutaneo rispetto al grasso omentale (viscerale) [64] . L'accumulo di prove suggerisce che gli interventi di esercizio fisico possono anche influenzare la metilazione del DNA. La maggior parte di questi studi sono stati condotti su individui magri [80-82], ma uno studio sull'esercizio su soggetti obesi con T2DM ha anche dimostrato cambiamenti nella metilazione del DNA, inclusi i geni coinvolti nel trasporto degli acidi grassi e del glucosio [83]. I cambiamenti epigenetici si verificano anche con l'invecchiamento e dati recenti suggeriscono un ruolo dell'obesità nell'aumentarli [9, 84, 85]. L'obesità ha accelerato l'età epigenetica del tessuto epatico, ma in contrasto con i risultati sopra descritti, questo effetto non era reversibile dopo la perdita di peso [84].
Ambiente postnatale: L'epigenoma viene stabilito de novo durante lo sviluppo embrionale e quindi l'ambiente prenatale ha molto probabilmente l'impatto più significativo sull'epigenoma. Tuttavia, è ora chiaro che i cambiamenti si verificano nell'epigenoma `` maturo '' sotto l'influenza di una serie di condizioni, tra cui l'invecchiamento, l'esposizione alle tossine e le alterazioni della dieta. Ad esempio, sono stati dimostrati cambiamenti nella metilazione del DNA in numerosi geni nel muscolo scheletrico e PGC1A nel tessuto adiposo in risposta a una dieta ricca di grassi [75, 76]. Anche gli interventi per perdere massa grassa sono stati associati a cambiamenti nella metilazione del DNA. Studi hanno riportato che i profili di metilazione del DNA del tessuto adiposo [43, 64], delle cellule mononucleate del sangue periferico [77] e del tessuto muscolare [78] nei pazienti precedentemente obesi diventano più simili ai profili dei soggetti magri dopo la perdita di peso. La chirurgia per la perdita di peso ha anche parzialmente invertito i cambiamenti di metilazione associati alla steatosi epatica non alcolica nel fegato [79] e in un altro studio ha portato all'ipometilazione di più geni candidati all'obesità, con effetti più pronunciati nel sottocutaneo rispetto al grasso omentale (viscerale) [64] . L'accumulo di prove suggerisce che gli interventi di esercizio fisico possono anche influenzare la metilazione del DNA. La maggior parte di questi studi sono stati condotti su individui magri [80-82], ma uno studio sull'esercizio su soggetti obesi con T2DM ha anche dimostrato cambiamenti nella metilazione del DNA, inclusi i geni coinvolti nel trasporto degli acidi grassi e del glucosio [83]. I cambiamenti epigenetici si verificano anche con l'invecchiamento e dati recenti suggeriscono un ruolo dell'obesità nell'aumentarli [9, 84, 85]. L'obesità ha accelerato l'età epigenetica del tessuto epatico, ma in contrasto con i risultati sopra descritti, questo effetto non era reversibile dopo la perdita di peso [84].
Complessivamente, le prove a sostegno della capacità di modulare l'epigenoma negli adulti suggeriscono che ci può essere la possibilità di intervenire nella vita postnatale per modulare o invertire la programmazione epigenetica avversa.
Dimensioni e differenze di effetto tra tipi di tessuto
![]() I cambiamenti di metilazione del DNA associati all'obesità o indotti dalla dieta o da interventi sullo stile di vita e la perdita di peso sono generalmente modesti (<15%), anche se questo varia a seconda del fenotipo e del tessuto studiato. Ad esempio, sono state riportate variazioni maggiori del 20% nel tessuto adiposo dopo la perdita di peso [64] e le associazioni tra metilazione HIF3A e BMI nel tessuto adiposo erano più pronunciate che nel sangue [52].
I cambiamenti di metilazione del DNA associati all'obesità o indotti dalla dieta o da interventi sullo stile di vita e la perdita di peso sono generalmente modesti (<15%), anche se questo varia a seconda del fenotipo e del tessuto studiato. Ad esempio, sono state riportate variazioni maggiori del 20% nel tessuto adiposo dopo la perdita di peso [64] e le associazioni tra metilazione HIF3A e BMI nel tessuto adiposo erano più pronunciate che nel sangue [52].
La rilevanza biologica dei cambiamenti di metilazione relativamente piccoli è stata interrogata. Tuttavia, nei tessuti costituiti da una miscela di tipi di cellule, un piccolo cambiamento nella metilazione del DNA può effettivamente riflettere un cambiamento significativo in una frazione cellulare specifica. L'integrazione dei dati epigenomiali con il trascrittome e altri dati epigenetici, come le modificazioni dell'istone, è importante, poiché i piccoli cambiamenti di metilazione del DNA potrebbero riflettere maggiori cambiamenti nella struttura della cromatina e potrebbero essere associati a cambiamenti più ampi nell'espressione genica. Occorre inoltre considerare il contesto genomico; piccole modifiche all'interno di un elemento regolatore come un promotore, un enhancer o un isolante possono avere significato funzionale. A questo proposito, DMRs per l'obesità, così come le regioni colpite da esposizione alla carestia prenatale e meQTL per i tracciati del metabolismo sono stati osservati per sovrapporre elementi di potenziamento [8, 43, 68]. Ci sono prove che la metilazione del DNA nelle regioni associate alla carestia potrebbe infatti influire sull'attività di miglioramento [68], sostenendo un ruolo di cambiamenti di metilazione indotti dalla nutrizione nella regolazione del gene.
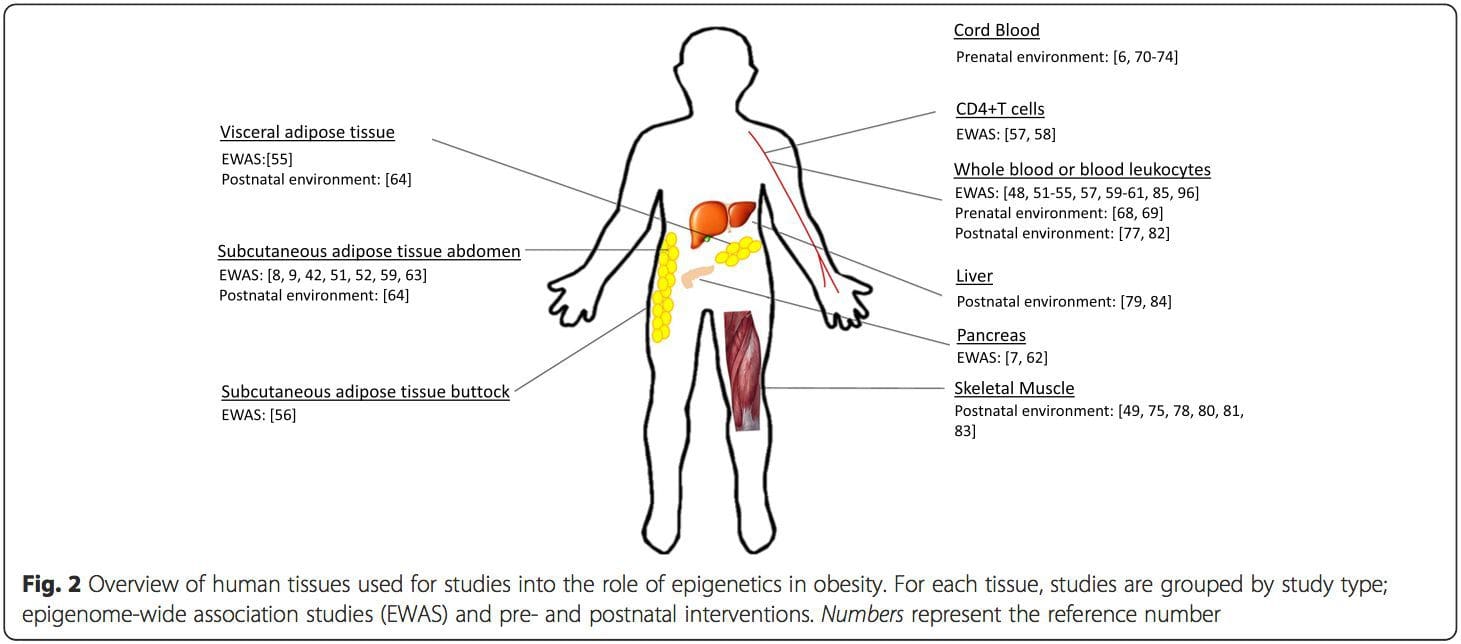
Una delle principali limitazioni in molti studi sull'uomo è che i segni epigenetici sono spesso valutati nel sangue periferico, piuttosto che nei tessuti metabolicamente rilevanti (Fig. 2). L'eterogeneità del sangue è un problema, poiché diverse popolazioni cellulari hanno firme epigenetiche distinte, ma sono stati sviluppati algoritmi per stimare la composizione cellulare per superare questo problema [86]. Forse ancora più importante, i segni epigenetici nelle cellule del sangue potrebbero non riportare necessariamente lo stato dei tessuti di interesse primario. Nonostante ciò, studi recenti hanno fornito una chiara evidenza di una relazione tra i segni epigenetici nelle cellule del sangue e il BMI. Nel caso di HIF3A per il quale il livello di metilazione (valore beta) nella popolazione in studio era compreso tra 0.14-0.52, un aumento del 10% della metilazione è stato associato a un aumento del BMI del 7.8% [52]. Allo stesso modo, una differenza del 10% nella metilazione PGC1A può prevedere una differenza fino al 12% nella massa grassa [54].
 Conclusioni
Conclusioni
Lo studio del ruolo dell'epigenetica nell'obesità e nella malattia metabolica si è rapidamente ampliato negli ultimi anni e si stima che si sia accumulato un legame tra modificazioni epigenetiche e risultati metabolici della salute negli esseri umani. Potenziali biomarcatori epigenetici associati all'obesità e alla salute metabolica sono emersi anche dagli studi recenti. La validazione dei segni epigenetici in più coorti, il fatto che diversi marchi sono trovati nei geni con una funzione plausibile nell'obesità e nello sviluppo di T2DM, nonché la sovrapposizione di marcature epigenetiche con obesità nota e locani genetici T2DM rafforza l'evidenza che queste associazioni sono vero. La causalità è stata finora stata difficile da stabilire; tuttavia, indipendentemente dal fatto che le associazioni siano causali, i marchi epigenetici identificati possono ancora essere rilevanti per i biomarcatori obesità e rischio di malattia metabolica.
Le dimensioni degli effetti in tessuti facilmente accessibili come il sangue sono piccole ma sembrano riproducibili nonostante la variazione di etnia, tipo di tessuto e metodi di analisi [51]. Inoltre, anche piccoli cambiamenti nella metilazione del DNA possono avere un significato biologico. Un approccio integrativo di "omica" sarà cruciale per svelare ulteriormente le complesse interazioni tra l'epigenoma, il trascrittoma, il genoma e la salute metabolica. Gli studi longitudinali, che idealmente abbracciano più generazioni, sono essenziali per stabilire relazioni causali. Possiamo aspettarci altri studi di questo tipo in futuro, ma questo richiederà tempo.
Mentre gli studi sugli animali continuano a dimostrare un effetto di vita precoce nutrizionale l'esposizione sull'epigenoma e sulla salute metabolica della prole, i dati sull'uomo sono ancora limitati. Tuttavia, studi recenti hanno fornito prove chiare che l'esposizione a un'alimentazione non ottimale durante specifici periodi di sviluppo prenatale è associata a cambiamenti di metilazione nella prole e quindi ha il potenziale per influenzare il fenotipo adulto. Gli studi sugli animali saranno importanti per verificare i risultati sull'uomo in un ambiente più controllato, aiutare a determinare se i cambiamenti di metilazione identificati hanno un impatto sulla salute metabolica e svelare i meccanismi alla base di questa regolazione epigenetica intergenerazionale / transgenerazionale. Rimangono importanti questioni da affrontare anche l'identificazione dei meccanismi causali alla base delle risposte della memoria metabolica, la modalità di trasmissione degli effetti fenotipici nelle generazioni successive, il grado di impatto e stabilità del tratto trasmesso e l'identificazione di un contesto evolutivo globale e unificante. . Quest'ultimo è spesso incapsulato dall'ipotesi della risposta adattativa predittiva, cioè una risposta a un ambiente futuro anticipato che aumenta la forma fisica della popolazione. Tuttavia, questa ipotesi è stata sempre più messa in discussione in quanto vi sono prove limitate di un aumento della forma fisica più avanti nella vita [87].
In sintesi, i risultati sono promettenti, poiché i cambiamenti epigenetici sono legati alla salute metabolica degli adulti e agiscono come mediatore tra alterata nutrizione prenatale e il conseguente aumento del rischio di scarsa esposizione metabolica metabolica. Sono stati identificati nuovi segni epigenetici associati a misure di salute metabolica. L'integrazione di diversi strati di informazioni genomiche ha aggiunto un ulteriore supporto alle relazioni causali e sono stati ulteriori studi che mostrano gli effetti dell'ambiente pre- e postnatale sull'epigenoma e sulla salute. Mentre rimangono molte importanti domande, i recenti progressi metodologici hanno permesso ai tipi di studi di base su larga scala che dovranno affrontare le lacune della conoscenza. Il prossimo decennio promette di essere un periodo di grande attività in questo importante settore di ricerca.
Susan J. van Dijk1, Ross L. Tellam2, Janna L. Morrison3, Beverly S. Muhlhausler4,5 e Peter L. Molloy1 *
Interessi conflittuali
Gli autori dichiarano di non avere interessi in gioco.
Contributi degli autori
Tutti gli autori hanno contribuito alla redazione e alla revisione critica del manoscritto, e tutti gli autori hanno letto e approvato il manoscritto finale.
Informazioni sugli autori
Beverly S. Muhlhausler e Peter L. Molloy sono degli ultimi autori.
Ringraziamenti
Questo lavoro è stato sostenuto da una sovvenzione del fondo per la scienza e l'industria (Grant RP03-064). JLM e BSM sono supportati dalle borse di studio per lo sviluppo della carriera (JLM, APP1066916, BSM, APP1004211) della National Health and Medical Research Council. Ringraziamo Lance Macaulay e Sue Mitchell per la lettura critica e le osservazioni sul manoscritto.
Dettagli dell'autore
1CSIRO Food and Nutrition Flagship, PO Box 52, North Ryde, NSW 1670, Australia. 2CSIRO Agriculture Flagship, 306 Carmody Road, St Lucia, QLD 4067, Australia. 3Early Origins of Adult Health Research Group, School of Pharmacy and Medical Sciences, Sansom Institute for Health Research, University of South Australia, GPO Box 2471, Adelaide, SA 5001, Australia 4FOODplus Research Center, Waite Campus, The University of Adelaide, PMB 1, Glen Osmond, SA 5064, Australia. 5 Istituto di ricerca sulla salute per donne e bambini, 72 King William Road, North Adelaide, SA 5006, Australia.
luminoso
Riferimenti:
1. CHI. CHI | Sovrappeso e obesità. www.who.int/gho/ncd/
risk_factors / sovrappeso / it / index.html. Accesso a 29 gennaio 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Cinque anni di scoperta di GWAS.
Sono J Hum Genet. 2012; 90: 7.
3. Locke AE, Kahali B, Berndt SI, giustizia AE, Pers TH, giorno FR, et al. Genetico
gli studi sull'indice di massa corporea forniscono nuove conoscenze per la biologia dell'obesità. Natura.
2015; 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, Rnn T, Granhall C, Luthman H, et al.
Regolazione epigenetica di PPARGC1A in isole diabetiche di tipo 2 umano e
effetto sulla secrezione di insulina. Diabetologia. 2008; 51: 615-22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. L'epigenetica
e l'obesità umana. Int J Obes (Lond). 2015; 39: 85 97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, et al. L'effetto di
genotipo e nell'utero ambiente sulla variabilità interindividuale nel neonato
Metilomi del DNA. Genome Res. 2014; 24: 1064 74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA, et al. genomewide
associazioni tra influenza genetica e variazioni epigenetiche
l'espressione di mRNA e la secrezione di insulina negli isolotti pancreatici umani. PLoS
Genet. 2014; 10: e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, et al.
Analisi globale della variazione della metilazione del DNA nel tessuto adiposo dai gemelli
rivela i collegamenti alle varianti associate alle malattie negli elementi regolatori distali.
Sono J Hum Genet. 2013; 93: 876.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Impatto dell'età, dei livelli BMI e HbA1c sul DNA genoma-wide
metilazione e espressione di espressione di mRNA nel tessuto adiposo umano
e l'identificazione di biomarcatori epigenetici nel sangue. Hum Mol Genet.
2015; 24: 3792 813.
10. Waterland RA, Michels KB. Epidemiologia epigenetica dello sviluppo
ipotesi delle origini. Annu Rev Nutr. 2007; 27: 363.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, et al. Le prime origini dell'obesità successiva: percorsi e meccanismi. adv
Exp Med Biol. 2009; 646: 71.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C, et al.
Tolleranza al glucosio negli adulti dopo l'esposizione prenatale alla carestia. Lancetta.
1998; 351: 173 7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Origini dello sviluppo della salute e della malattia degli adulti: il ruolo di
la nutrizione periconceptional e fetale. Basic Clin Pharmacol Toxicol.
2008; 102: 82 9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. periconcezionale
la nutrizione e la programmazione precoce di una vita di obesità o avversità. Prog
Biophys Mol Biol. 2011; 106: 307-14.
15. Bouret S, Levin BE, Ozanne SE. Controllo delle interazioni genico-ambiente
l'energia e l'omeostasi del glucosio e le origini dello sviluppo dell'obesità.
Physiol Rev.2015; 95: 47 82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, et al.
L'obesità materna aumenta la differenziazione e l'alterazione del tessuto adiposo bianco
metilazione di DNA su scala genoma in prole di topo maschile. Endocrinologia.
2013; 154: 4113 25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. La plasticità metabolica durante lo sviluppo dei mammiferi è orientata
dipendente dal primo stato nutrizionale. Proc Natl Acad Sci US A.
2007; 104: 12796 800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
et al. È associata la metilazione epigenetica del promotore del gene alla nascita
successiva adiposità del bambino. Diabete. 2011; 60: 1528 34.
19. McMillen IC, Adam CL, Muhlhausler BS. Origini precoce dell'obesità:
programmazione del sistema di regolazione dell'appetito. J Physiol. 2005; 565 (Pt 1): 9-17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, et al.
I cambiamenti epigenetici nei percorsi di regolazione dell'energia ipotalamica fetale sono
associati all'internatoria materna e al gemellaggio. FASEB J.
2012; 26: 1694 703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, et al. Obesità materna
e il diabete può causare alterazioni della metilazione del DNA negli spermatozoi di
prole in topi. Reprod Biol Endocrinol. 2014; 12: 29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, et al.
La subnomatizzazione perinatale influenza la metilazione e l'espressione della leptina
gene negli adulti: implicazione per la comprensione della sindrome metabolica.
FASEB J. 2011; 25: 3271 8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
La dieta materna durante la gravidanza induce l'espressione genica e il DNA
cambiamenti di metilazione nei tessuti fetali delle pecore. Genet anteriore. 2013; 4: 49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, et al.
L'obesità materna e il diabete inducono difetti metabolici latenti e
cambiamenti epigenetici diffusi nei topi isogenici. Epigenetica. 2013; 8: 602-11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Proteina dietetica
la restrizione dei ratti in stato di gravidanza induce e l'integrazione dell'acido folico impedisce
modificazione epigenetica dell'espressione genica epatica nella prole. J Nutr.
2005; 135: 1382 6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaite E, et al. In utero
effetti. In malnutrizione utero perturbs il metilome di sperma adulto
e il metabolismo intergenerazionale. Scienza. 2014; 345 (80): 1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, et al.
Epigenomica: l'esposizione materna ad alto contenuto di grassi nell'utero interferisce
espressione circadiana periferica nei primati non umani. FASEB J.
2011; 25: 714 26.
28. Suter MA, Ma J, PM Vuguin, Hartil K, Fiallo A, Harris RA, et al. In utero
l'esposizione a una dieta materna ad alto contenuto di grassi altera il codice istone epigenetico in a
modello murino. Am J Obs Gynecol. 2014; 210: 463 e1 463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, et al.
Epigenetica dell'obesità programmata: alterazione del IGF1 epatico in IUGR
l'espressione di mRNA e la struttura degli istoni in rapida e postnatale ritardata
crescita di recupero. Am J Physiol Gastrointest Liver Physiol.
2010; 299: G1023 9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
et al. La dieta materna e l'invecchiamento alterano il controllo epigenetico di un promoter
interazione al gene Hnf4a negli isole pancreatiche del ratto. Proc Natl
Acad Sci US A. 2011; 108: 5449.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Ricerche su
risposta transgenerazionale epigenetica lungo la linea maschile nei suini F2. PLoS
Uno. 2012, 7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, et al. paternamente
indotta dalla riprogettazione ambientale transgenerazionale delle sostanze metaboliche
espressione genica nei mammiferi. Cellula. 2010; 143: 1084 96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. Dieta paterna
definisce lo stato di cromatina offspring e l'obesità intergenerazionale. Cellula.
2014; 159: 1352 64.
34. Martínez D, Pentinat T, Rib S, Daviaud C, Bloks VW, Cebri J, et al. In utero
la sottovalutazione nei topi maschi programma il metabolismo lipidico del fegato nella seconda generazione
prole che coinvolgono la metilazione alterata di Lxra DNA. Cell Metab.
2014; 19: 941 51.
35. Wei Y, Yang CR, Yi Wei, Zhao ZA, Hou Y, Schatten H, et al. paternamente
indotta dall'eredità transgenerazionale della suscettibilità al diabete
mammiferi. Proc Natl Acad Sci US A. 2014; 111: 1873 8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Eredità epigenetica transgenerazionale: quanto è importante? Nat Rev
Genet. 2013; 14: 228 35.
37. Pembrey M, Saffery R, Bygren LO. Risposte transgenerative umane a
esperienza precoce: potenziale impatto sullo sviluppo, sulla salute e sulla salute
ricerca biomedica. J Med Genet. 2014; 51: 563 72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Epigenetica materna e metilico
i supplementi influenzano l'espressione del gene agouti nei topi di Avy / a. FASEB J.
1998; 12: 949 57.
39. Jirtle RL, Skinner MK. Epigenomica ambientale e suscettibilità alle malattie.
Nat Rev Genet. 2007; 8: 253.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Eredità epigenetica a
il locus agouti nel topo. Nat Genet. 1999; 23: 314 8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Epigenetico a germi lineari
modifica del murino A vy allele per integrazione nutrizionale. proc
Natl Acad Sci US A. 2006; 103: 17308-12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Proteina dietetica
la restrizione durante la gravidanza di F0 nei ratti induce i cambiamenti transgenerazionali in
il transcriptome epatico nelle prole femminili. PLoS One. 2011, 6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, et al. Mousehuman
l'analisi epigenetica sperimentale disattiva gli obiettivi dietetici e
responsabilità genetica per fenotipi diabetici. Cell Metab. 2015; 21: 138.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Raccomandazioni per la progettazione e l'analisi di epigenomi
studi di associazione. Metodi Nat. 2013; 10: 949 55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, Rnn T, Ling C. Identificazione di
CpG-SNP associati al diabete di tipo 2 e alla metilazione differenziale del DNA
nelle isole pancreatiche umane. Diabetologia. 2013; 56: 1036 46.
46. Relton CL, Davey Smith G. Randomizzazione epigenetica a due fasi Mendeliana: a
strategia per stabilire il ruolo causale dei processi epigenetici nei percorsi
alla malattia. Int J Epidemiol. 2012; 41: 161 76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
I dati relativi all'associazione di epigenomi implicano la metilazione del DNA come un
intermediario di rischio genetico nell'artrite reumatoide. Nat Biotechnol.
2013; 31: 142 7.
48. Yuan W, Xia Y, Bell CG, Eppure io, Ferreira T, Ward KJ, et al. Un integrato
analisi epigenomica per locche di suscettibilità del diabete di tipo 2 in monozygotic
Gemelli. Nat Commun. 2014; 5: 5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Impatto di un
esercitare l'intervento sulla metilazione del DNA nei muscoli scheletrici da primo grado
parenti di pazienti con diabete di tipo 2. Diabete. 2012; 61: 3322 32.
50. Gagnon F, A ssi D, Carri A, Morange PE, Tr gou t DA. Robusta convalida di
l'associazione di livelli di metilazione al luogo CPT1A con livelli plasmatici lipidi.
J Lipid Res. 2014; 55: 1189 91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. Associazione di associazione a livello epigenome (EWAS) del BMI, cambiamento BMI e
la circonferenza della vita negli adulti afro-americani identifica molteplici repliche
loci. Hum Mol Genet. 2015: ddv161 .
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, Assi D, Wahl S, et al. DNA
metilazione e indice di massa corporea: un'analisi su base genomica. Lancetta.
2014; 6736: 1 9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, et al. Metilazione del DNA di
il gene LY86 è associato a obesità, resistenza all'insulina e
infiammazione. Twin Res Hum Genet. 2014; 17: 183-91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
PGC1? la metilazione del promotore nel sangue a 5 7 anni predice l'adiposità da
Da 9 a 14 anni (EarlyBird 50). Diabete. 2014; 63: 2528 37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
ADRB3 promotore del gene Metilazione del DNA nel sangue e nell'adipo viscerale
il tessuto è associato a disturbi metabolici negli uomini. Epigenomics.
2014; 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. L'adiposità è
associato al profilo di metilazione del DNA nel tessuto adiposo. Int J Epidemiol.
2014: 1.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, et al.
Studi sull'associazione di epigenomi su digestivi lipidi nel sangue nella genetica di
farmaci ipolipemizzanti e studio di reti dietetiche. Circolazione. 2014; 130: 565 72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, et al.
La metilazione in loco CPT1A è associata alla subfrazione lipoproteina
profili. J Lipid Res. 2014; 55: 1324-30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, et al. DNA
la metilazione dei geni correlati ai lipidi influenza i livelli lipidici nel sangue. Circ Cardiovasc
Genet. 2015.
60. Petersen AK, Zeilinger S, Kastenm ller G, R misch-Margl W, Brugger M, Peters
A, et al. L'epigenetica si incontra con il metabolomics: un'associazione di epigenomi
studio con i tratti metabolici del siero del sangue. Hum Mol Genet. 2014; 23: 534 45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, et al. Epigenomewide
studio di associazione delle misure di digiuno di glucosio, insulina e HOMA-IR
nella genetica dei farmaci che riducono i lipidi e lo studio della rete dietetica. Diabete.
2014; 63: 801 7.
62. Dayeh T, Volkov P, Salé S, Hall E, Nilsson E, Olsson AH, et al. A livello di genoma
Analisi della metilazione del DNA di isole pancreatiche umane del diabete tipo 2
ei donatori non diabetici identificano i geni candidati che influenzano l'insulina
secrezione. PLoS Genet. 2014, 10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, et al.
Metilazione alterata del DNA e espressione differenziale di geni che influenzano
metabolismo e infiammazione nel tessuto adiposo da soggetti con tipo 2
diabete. Diabete. 2014; 63: 2962 76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, et al. L'analisi della metilazione del DNA nel tessuto adiposo umano rivela una modifica differenziale dei geni dell'obesità prima e dopo il bypass gastrico e il peso
perdita. Gene. 2015; 16: 1 21.
65. Bateson P, Gluckman P. La plasticità e la robustezza nello sviluppo e nel
Evoluzione. Int J Epidemiol. 2012; 41: 219.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evoluzione nella salute e nella salute
medicina Sackler colloquium: variazione epigenetica stocastica come guida
forza di sviluppo, adattamento evolutivo e malattia. Proc Natl Acad
Sci US A. 2010; 107 (Suppl): 1757-64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, et al.
Analisi longitudinale su scala genomica della metilazione del DNA nei gemelli dalla nascita
a 18 mesi di età rivela un rapido cambiamento epigenetico nella vita precoce e pairspecific
effetti della discordanza. Genome Biol. 2013; 14: R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, et al. DNA
le firme di metilazione collegano l'esposizione alla carestia prenatale alla crescita e alla
metabolismo. Nat Commun. 2014; 5: 5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, et al.
L'alimentazione materna alla concezione modula la metilazione del DNA umana
epiallelici metastabili. Nat Commun. 2014; 5: 3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, et al.
Impatto sui modelli di metilazione prole di diabete gestazionale materno
il mellito e la ritenzione della crescita intrauterina suggeriscono i geni comuni e
percorsi legati al successivo rischio di diabete di tipo 2. FASEB J. 2014: 1 12.
71. Morales E, Groom A, Lawlor DA, Relton CL. Marcature di metilazione del DNA in
il sangue del cordone associato all'aumento del peso gestazionale materno: risultati da
la coorte ALSPAC. BMC Res Notes. 2014; 7: 278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
Il diabete mellito gestazionale influenza epigeneticamente prevalentemente i geni
coinvolto nelle malattie metaboliche. Epigenetica. 2013; 8: 935 43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, et al. Materno
l'indice di massa corporea di preconzione e il DNA del sangue del midollo spoglio
metilazione: esplorazione delle origini della vita precoce della malattia. Environ Mol
Mutageno. 2014; 55: 223-30.
74. Soubry A, Murphy SK, Wang F., Huang Z, Vidal AC, Fuemmeler BF, et al.
I neonati di genitori obesi hanno alterato i modelli di metilazione del DNA a
geni impressi. Int J Obes (Lond). 2015; 39: 650 7.
75. Jacobsen SC, Brens C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Effetti di sovraesposizione ad alto contenuto di grassi a breve termine su DNA a livello genomico
metilazione nel muscolo scheletrico di giovani sani. Diabetologia.
2012; 55: 3341 9.
76. Gillberg L, Jacobsen SC, Rnn T, Brns C, Vaag A. PPARGC1A DNA
metilazione nel tessuto adiposo sottocutaneo in soggetti con basso peso alla nascita
impatto di 5 giorni di sovralimentazione ad alto contenuto di grassi. Metabolismo. 2014; 63: 263 71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Disegni epigenetici in riusciti gestori di perdita di peso: uno studio pilota. Int J
Obes (Lond). 2015; 39: 865 8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N slund E,
Zierath JR. La perdita di peso dopo l'intervento chirurgico di bypass gastrico nell'obesità umana
rimodella la metilazione del promotore. Cell Rep.2013: 1 8.
79. Ahrens M, Ammerpohl O, von Schnfels W, Kolarova J, Bens S, Itzel T, et al.
L'analisi della metilazione del DNA nella malattia epatica non alcolica del fegato suggerisce
distinte specifiche di malattia e rimodellamento dopo la chirurgia bariatrica.
Cell Metab. 2013; 18: 296-302.
80. Voisin S, Eynon N, Yan X, vescovo DJ. Formazione di esercitazione e metilazione del DNA
negli umani. Acta Physiol (Oxf). 2014; 213: 39.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekstr m TJ,
Tegn r J, et al. Un'analisi integrativa rivela una riprogrammazione coordinata
dell'epigenoma e del trascrittome nel muscolo scheletrico umano dopo
formazione. Epigenetica. 2014; 9: 1557 69.
82. Denham J, O'Brien BJ, Marques FZ, Charchar FJ. Cambiamenti nei leucociti
metilome e il suo effetto sui geni correlati cardiovascolari dopo l'esercizio fisico.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, pagina RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I, et al.
Le reti integrate multi-omiche collegano la metilazione del DNA e miRNA
la plasticità muscolare dello scheletro all'esercizio cronico nell'obesità diabetica di tipo 2.
Physiol Genomics. 2014; 46: 747.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
et al. L'obesità accelera l'invecchiamento epigenetico del fegato umano. Proc Natl Acad
Sci. 2014; 111: 15538 43.
85. Almn MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
L'analisi genomica rivela i marcatori di metilazione del DNA che variano con
sia l'età che l'obesità. Gene. 2014.; 548: 61 7
86. Houseman EA, Molitor J, Marsit CJ. Regolazioni della miscela delle cellule senza riferimento
nell'analisi dei dati di metilazione del DNA. Bioinformatica. 2014; 30: 1431-9.
87. Wells JC. Una valutazione critica dell'ipotesi di risposta adattativa predittiva.
Int J Epidemiol. 2012; 41: 229 35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, et al. Numero di embrioni e sottovalutazione percepitiva nella
le pecore hanno effetti differenziali sull'epigenotipo surrenale, sulla crescita, e sulla
sviluppo. Sono J Physiol Endocrinol Metab. 2014; 307: E141 50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
L'obesità materna e le prime origini dell'obesità infantile: pesa
i benefici e i costi della perdita di peso materno nel periconceptional
periodo per la discendenza. Exp Diabetes Res. 2011; 2011: 585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, et al. La sottovalutazione materna durante la prima settimana dopo la concezione
si traduce in una diminuzione dell'espressione del mRNA del recettore del glucocorticoide nel
assenza di ipermetilazione di GR exon 17 nell'ipofisi fetale in ritardo
gestazione. J Dev Orig Heal Dis. 2013; 4: 391 401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
et al. I programmi di sopravvivenza percepitivi modificano i segnali di insulina
molecole e microRNA nei muscoli scheletrici in singleton e in due feti
pecore. Biol Reprod. 2014; 90: 5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ, et al. L'attivazione del recettore del feto al fegato X induce acutamente la lipogenesi ma
non influenza la risposta lipidica al plasma ad una dieta ad alta percentuale di grassi nei topi adulti. Am J
Physiol Endocrinol Metab. 2009; 297: E1171 8.
93. Fernandez-Twinn DS, Alfaradhi MZ, MS Martin-Gronert, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, et al. Downregulation di IRS-1 in
il tessuto adiposo della prole di topi obesi è programmato in modo cellautonomico
attraverso meccanismi post-trascrizionali. Mol Metab.
2014; 3: 325 33.
94. Waterland RA, Travisano M, Tahiliani KG. Ipermetilazione indotta dalla dieta a
l'agouti giallo vitale non è ereditato transgenerazionalmente attraverso la femmina.
FASEB J. 2007; 21: 3380 5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, et al. Metilazione del DNA in
oociti e fegato di topi femminili e loro prole: effetti di alto contenuto di grassi-dieta indotta
obesità. Env Heal Perspect. 2014; 122: 159.
96. Ollikainen M, Ismail K, Gervin K, Kyllénen A, Hakkarainen A, Lundbom J, et al.
Alterazioni di metilazione del DNA nel sangue a livello genomico agli elementi regolatori
e regioni eterocromatiche in gemelli monozigoti discordanti per l'obesità
e grasso di fegato. Clin Epigenetics. 2015; 7: 1 13.
Chiudi fisarmonica
Le informazioni qui riportate su "Il ruolo dell'epigenetica nell'obesità e nella malattia metabolica" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale






