La salute dell'apparato digerente può essere attribuita alla funzione ottimale del tratto gastrointestinale. A titolo di esempio, tuttavia, se la malattia colpisce la struttura dell'intestino, comprendendo la sua anatomia e la sua funzione, può aiutare gli specialisti sanitari a concludere un esito diagnostico. L'epitelio intestinale è un singolo strato di cellule trovate che rivestono il lume intestinale, che svolge il ruolo di svolgere due funzioni essenziali nel sistema digestivo. La sua prima funzione è quella di fungere da barriera per impedire il passaggio di entità intraluminali dannose, come antigeni estranei, microrganismi e le loro tossine. La sua seconda funzione è quella di agire come un filtro selettivo, consentendo la traslocazione di importanti nutrienti alimentari, elettroliti e acqua dal lume intestinale al flusso sanguigno. L'epitelio intestinale distingue la permeabilità selettiva attraverso due vie principali: la via transepiteliale / transcellulare e paracellulare, come mostrato nella Figura 1.
La permeabilità transcellulare è generalmente correlata alle cellule epiteliali ed è ampiamente regolata da specifici trasportatori incaricati di trasferire anche aminoacidi, elettroliti, acidi grassi a catena corta e zuccheri in tutto il corpo umano. La permeabilità paracellulare è solitamente correlata alla distanza di trasferimento tra le cellule epiteliali ed è fortemente regolata dai complessi intercellulari che si trovano nella giunzione della membrana apicale-laterale e lungo la membrana laterale del tratto gastrointestinale, o tratto GI. L'interazione tra le cellule epiteliali intestinali coinvolge tre componenti che possono essere identificate a livello ultrastrutturale: desmosomi, giunzioni aderenti o AJ e giunzioni strette, o TJ, come mostrato nella Figura 2. I complessi giunzionali adesivi sono costituiti da proteine transmembrana che collegano le cellule adiacenti al citoscheletro di actina attraverso proteine di scaffold citoplasmatiche. Si ritiene che le giunzioni aderenti e i desmosomi siano più significativi del collegamento meccanico delle cellule adiacenti. Le giunzioni strette, d'altra parte, sono il complesso giunzionale più apicale, responsabile della chiusura dello spazio intercellulare e della regolazione dello specifico trasferimento ionico paracellulare di soluto. I complessi AJ e TJ sono anche essenziali per la regolazione della proliferazione, polarizzazione e distinzione cellulare.
Contenuti
Componenti strutturali dei complessi giunzionali
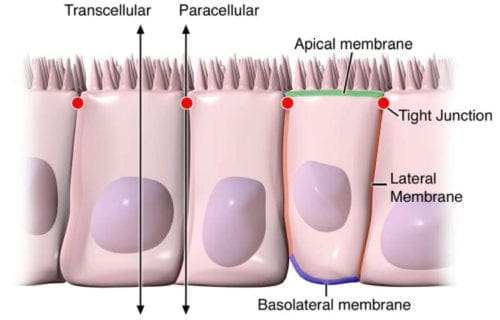
Figure 1
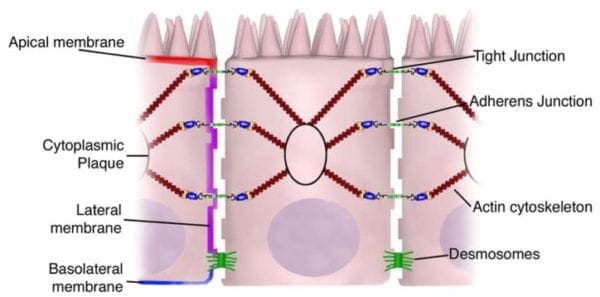
Figure 2
Adherens Junctions (AJs)
Le giunzioni aderenti, note anche come zonula aderenti, sono complessi proteici situati lungo la membrana laterale che avvengono nei punti di contatto cellula-cellula, come si vede nella Figura 2. Sono modellati dalle interazioni tra le proteine transmembrana, le proteine adattatrici intracellulari e il citoscheletro . Le principali giunzioni AJ, o aderenti, sono formate dalle interazioni tra caderina e catenina. Le (E) -caderine epiteliali, o molecole di adesione calcio-dipendenti, sono glicoproteine transmembrana singole di tipo I che contengono un C-terminale intracellulare e un N-terminale extracellulare. Il dominio extracellulare crea interazioni omotipiche con le caderine delle cellule vicine per sviluppare questa cellula all'adesione cellulare. Il dominio intracellulare contiene un dominio legante la catenina che interagisce con i membri della superfamiglia delle ripetizioni dell'armadillo,? -,? - e p120-catenina. Le catenine quindi collegano gli AJ nella rete citoscheletrica attraverso il legame diretto al dominio C-terminale dell'actina F o indirettamente attraverso le interazioni con altre proteine adattatrici come l'afadina. I complessi da caderina a catenina sono significativi non solo per collegare le cellule adiacenti, ma anche per mantenere la polarità cellulare e per regolare la migrazione e la proliferazione epiteliale, nonché la formazione di complessi adesivi aggiuntivi, come i desmosomi. Al fine di consentire il collegamento delle cellule adiacenti, una diminuzione della regolazione della E-caderina dall'epitelio intestinale interrompe l'adesione cellula a cellula che è stata associata alla proliferazione e migrazione dell'epitelio intestinale interessato.
Le interazioni nectina-afadina creano un altro complesso AJ significativo. Le nectine, in particolare la nectina-1-4, sono proteine simili alle immunoglobuline che resistono alle interazioni omofile ed eterofile con le nectine sulle cellule adiacenti. Le nectine possono interagire con il citoscheletro attraverso l'afadina, una proteina legante l'actina F, o meglio preferibilmente attraverso le interazioni con altre proteine leganti la F- o? -Actina comprese le proteine che interagiscono con il dominio di ponsin / SH3P12, vinculina e afadin dil.
Tight Junctions (TJs)
Le giunzioni strette sono i complessi giunzionali adesivi più apicali nelle cellule epiteliali dei mammiferi che sviluppano un anello continuo simile a un nastro attorno alle cellule epiteliali al confine tra le regioni di membrana apicale e laterale del tratto gastrointestinale, secondo la Figura 2. Le giunzioni strette, o TJ, sono potenti complessi multi-proteici che fungono da barriera paracellulare selettiva / semipermeabile, che facilita il passaggio di ioni e soluti attraverso lo spazio intercellulare, impedendo nel contempo la traslocazione di antigeni luminali, microrganismi e le loro tossine. La progressione della biologia di TJ è iniziata negli 1960 con lo sviluppo della microscopia elettronica. La valutazione e l'analisi delle cellule epiteliali spiegavano una serie di fusioni apparenti, in cui lo spazio tra cellule epiteliali adiacenti era stato eliminato. Questi cosiddetti "punti di bacio" sono morfologicamente diversi da AJ e desmosomi, dove le membrane cellulari adiacenti rimangono approssimativamente da 15 a 20nm. Fin dalle prime osservazioni, TJ è stato trovato includere quattro famiglie di proteine transmembrana: occludina, claudine, molecole di adesione giunzionali o JAM e tricellulina.
I domini extracellulari di proteine TJ transmembrane in cellule adiacenti anastomizzano per modellare l'isolato di TJ. Queste interazioni coinvolgono quelle proteine che si trovano nella stessa membrana e quelle che includono le proteine nelle cellule adiacenti. Inoltre, le proteine TJ possono formare interazioni omofile, con la stessa identica proteina, o interazioni eterofile, tra proteine TJ non identiche. Come le giunzioni aderenti, i domini intracellulari interagiscono con diverse proteine di scaffolding, proteine dell'adattatore e complessi di segnalazione per moderare l'attaccamento del citoscheletro, la polarità cellulare, la segnalazione cellulare e il traffico di vescicole, come mostrato nella Figura 3. Le regioni intracellulari di AJ possiedono domini PDZ-binding, che raccolgono e vengono in contatto con proteine contenenti dominio PDZ. Il dominio PDZ (Post synaptic density-95 / Drosophila disk large / Zonula occludens-1 protein) è un dominio strutturale comune di circa 80 agli aminoacidi 90 che svolgono il ruolo di ancoraggio delle proteine transmembrana al citoscheletro. I domini intracellulari possono anche interagire con il dominio di associazione non PDZ, comprese le proteine come il cingulin, che possono interagire con le proteine della membrana giunzionale, il citoscheletro di actina e le proteine di segnalazione. La complessa rete di interazioni proteiche intracellulari può anche essere conosciuta come la "placca citoplasmatica".
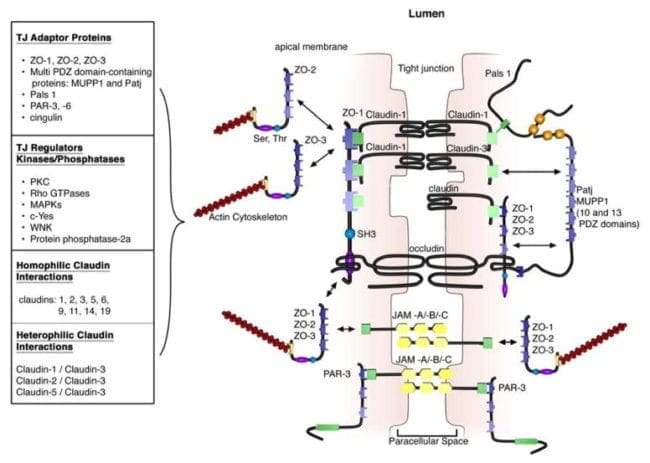
Figure 3
Formazione di giunzione stretta nel tratto gastrointestinale
L'epitelio intestinale forma la barriera più grande e più essenziale tra i nostri ambienti del tratto gastrointestinale esterno e interno. La barriera è preservata dalla presenza di AJ e TJ, come caderine, claudine, occludine e proteine JAM, che isolano gruppi di cellule adiacenti e mantengono l'ancoraggio citoscheletrico, come mostrato nella Figura 3. L'espressione delle proteine giunzionali nell'intestino è altamente regolata e dipende dall'intestino tenue e / o crasso, dalla posizione dei villi / cripte e dalla specificità della membrana cellulare; apicale, laterale o basolaterale. Il complesso pattern dell'espressione di TJ dall'intestino è correlato alle particolari funzioni di una distinta regione e posizione intestinale. L'espressione delle giunzioni aderanti e delle proteine a giunzioni strette può anche essere controllata dalla fosforilazione, secondo la tabella 1. La fosforilazione può promuovere la formazione di TJ e la funzione di barriera, o in alternativa promuovere la ridistribuzione della proteina TJ e la complessa destabilizzazione.
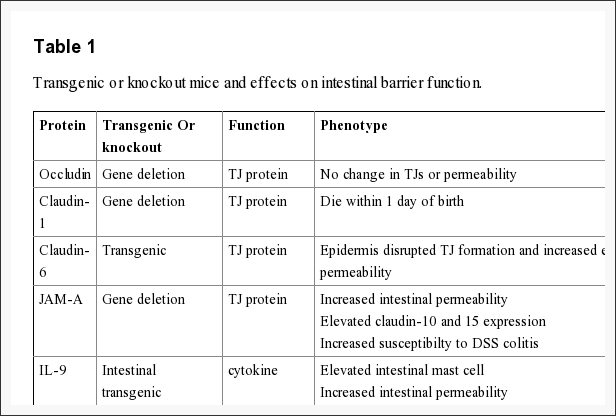
occludina
Una delle prime proteine di membrana integrale che appartengono specificamente alle giunzioni strette da riconoscere è l'occludina. L'occludina si trova prevalentemente nelle cellule epiteliali ed endoteliali dei TJ, ma può anche essere localizzata negli astrociti, nei neuroni e nelle cellule dendritiche. Occludin (60 to 82 kDa) è una proteina di membrana integrale tetraspanning composta da due anelli extracellulari, un breve N-terminale citoplasmatico e un lungo terminale C citoplasmatico. L'analisi e la valutazione della funzione di questi hanno dimostrato che i circuiti extracellulari e i domini transmembrana dell'occludina gestiscono e mantengono la permeabilità paracellulare selettiva. Intracellularmente, il C-terminale interagisce con il dominio PDZ contenente la proteina ZO-1, che è necessaria per collegare l'occludina al citoscheletro di actina, secondo la Figura 3.
Diverse isoforme occludiniche sono caratterizzate e ritenute il risultato di uno splicing alternativo di mRNA. Abbastanza distintamente, molte varianti di splicing dimostrano alterata distribuzione subcellulare e interazione con altre molecole di TJ. La valutazione di queste varianti di splicing ha mostrato che il dominio C-terminale citoplasmatico è funzionale per lo scambio intracellulare di occludina alla membrana cellulare laterale, che il quarto nome di dominio transmembrana è importante per il targeting dell'occludina nel TJ e per le interazioni ZO-1.
Il ruolo dell'occludin non è delineato completamente; tuttavia, i dati suggeriscono un'altra funzione per l'occludina dalla regolazione della permeabilità paracellulare. Il principale allergene dell'acaro della polvere domestica, Der p 1, era determinato a disturbare proteoliticamente l'occludina alterando questo complesso di TJ e aumentando la permeabilità paracellulare. Inoltre, il trattamento con idrocortisone delle cellule endoteliali retiniche bovine ha migliorato l'espressione dell'occludina due volte e ha migliorato le proprietà barriera monostrato. Sebbene l'occludina sia un elemento importante di TJ, la formazione di TJ e la funzione di barriera di permeabilità paracellulare non dipendono dall'occludina. Indagini sperimentali di occludina su topi hanno dimostrato numeri equivalenti e gruppi di TJ e corrispondente passaggio di ioni paracellulari come topi selvatici. Inoltre, il trasporto epiteliale e la funzione di barriera erano normali nei topi con occludina. Insieme alla regolazione della permeabilità paracellulare, ci sono prove che indicano che l'occludina è inclusa nell'adesione cellulare. La lunghezza dell'occludina nei fibroblasti di occludina e ratto conferiva l'adesione da cellula a cellula che è stata formalmente interrotta da peptidi sintetici associati al primo anello extracellulare di occludina, sottolineando il significato dell'area di occludina nell'adesione cellulare.
Le valutazioni hanno indicato che l'occludina trovata lungo il complesso TJ è regolata dalla fosforilazione. Sono stati identificati diversi potenziali siti di fosforilazione in tirosina, serina e treonina residui di occludina in cui si propone che la regolazione della fosforilazione di occludina avvenga da chinasi, ad esempio, tirosin chinasi c-Sì non recettore e protein chinasi C (PKC), e le fosfatasi inclusa la fosfatasi proteica serina / treonina 2A, secondo la Figura 3. PKC?, una nuova proteina chinasi espressa prevalentemente nell'epitelio intestinale, è stata dimostrata fosforilare direttamente l'occludina nei residui di treonina (T403 e T404). Il blocco di tutta la fosforilazione dell'occlusione mediata da PKC? Ha interrotto la distribuzione giunzionale di occludina e ZO-1 e ha interrotto la funzione di barriera epiteliale. I dati suggeriscono che la fosforilazione di occludina modula le interazioni occludina-ZO-1 e il mantenimento dei complessi TJ intatti e della funzione di barriera paracellulare.
claudine
Le claudine sono 20 e 27 kDa proteine di membrana integrale con quattro domini transmembrana idrofobici, due anelli extracellulari e N- insieme a domini citoplasmatici C-terminali. I loop extracellulari sono cruciali per la proteina TJ omofila e / o eterofila per le interazioni proteiche insieme alla creazione di canali ionoselettivi. Il dominio C-terminale intracellulare è incluso nell'ancoraggio della claudina nel citoscheletro attraverso connessioni con nomi di domini PDZ-vincolanti, come ZO-1, -2 e -3, secondo la Figura 3. Attualmente, i membri del recettore della famiglia delle claudine distinti 24 sono identificati in coloro che hanno un numero di ortologhi espressi in varie specie. Esibiscono routine distinte di espressione di cellule, tessuti e fase di sviluppo specifici.
Claudina per claudinare le interazioni tra cellule adiacenti potrebbe essere omofila o eterofila. Interazioni omofiliche sono state mostrate per claudine 1, 2, 3, 5, 6, 9, 11, 14 e 19. Sul retro, le interazioni eterofili sono più limitate e in gran parte sono state rilevate con claudin-3, che potrebbe interagire con claudine-1, -2 e -5. In particolare, c'è specificità nelle trans-interazioni eterofili. A titolo di esempio, la transfezione dei fibroblasti con claudine-1, -2 e -3 ha portato all'interazione di claudina-3 con claudina-1 e -2; tuttavia non sono state rilevate interazioni che coinvolgono claudin-1 e -2. Queste interazioni discernenti sono considerate per descrivere la diversità nelle formazioni di TJ e forniscono una base molecolare per l'eterogeneità tissutale della funzione di barriera.
Studi recenti, insieme a topi carenti di claudina, forniscono anche informazioni corroboranti a sostegno del ruolo delle claudine nella legge della funzione barriera. I topi Claudin-1 muoiono entro un giorno dalla nascita a causa di una significativa perdita di acqua transepidermica. Inoltre, la sovraespressione transgenica di claudina-6 nella pelle ha interrotto la formazione di giunzioni strette e una maggiore permeabilità epiteliale. I dati sperimentali indicano che le claudine potrebbero avere impatti differenziali sulla permeabilità paracellulare. Ad esempio, l'introduzione di claudina-2 a cellule MDCK I che dichiarano claudina-1 e -4 attiva una diminuzione della resistenza transepiteliale, o TER; considerando che la trasfezione di claudina-3 non ha avuto alcun effetto indicando che la claudina-2 ha notevolmente diminuito la rigenerazione del filamento TJ a base di claudina-1 / claudina-4. A sostegno delle più recenti prove sperimentali indica che le claudine possono formare misurazioni e stazioni paracellulari specifiche della carica. La trasfezione di claudina-8 in cellule MDCK II prive di claudina-8 endogena ha ridotto sostanzialmente il movimento paracellulare senza influire sull'anione e sul movimento del soluto non caricato. Le indagini sperimentali suggeriscono che il primo ciclo extracellulare di claudine gioca un ruolo essenziale nel decidere la selettività di carica. L'interscambio dei domini primitivi o extracellulari di claudina-4 su claudina-2 ha diminuito profondamente la conduttanza ionica di Na + rispetto a Cl? 76. Inoltre, la sostituzione di una lisina caricata negativamente in un po 'di acido aspartico caricato positivamente (K65D) all'interno del ciclo di claudina-15 ha generato un aumento della permeabilità Na +, mentre la mutazione esattamente nello stesso punto di tre amminoacidi caricati positivamente in carica negativa acido aspartico, arginina e acido aspartico (E46K, D55R e E64K) hanno alterato la selettività ionica della claudina-15 in Na + a Cl? canale. La dimensione e la densità dei pori possono anche influenzare il movimento paracellulare di soluti carichi non invasivi e carichi.
I claudine svolgono anche un ruolo essenziale nell'invasione e nella motilità delle cellule epiteliali. La sovraespressione di claudine-3 e -4 in cellule epiteliali ovariche umane, che mancano dell'espressione di queste proteine, è stata collegata a una maggiore sopravvivenza delle cellule epiteliali e ad una migliore invasività e motilità. Coerentemente con questa osservazione, il knockdown mediato da siRNA delle due claudine-3 e -4 nelle linee di cellule di carcinoma ovarico diminuiva l'intrusione. Il risultato di claudin-3 sembra essere connesso all'attività alterata della metalloproteasi della matrice 2, il che significa che l'invasione indotta da claudina potrebbe essere regolata dalle proteine della metalloproteasi.
Simile all'occludina, la localizzazione della claudina al complesso TJ e la sua funzione sono regolate dalla fosforilazione post-traduzionale e attraverso connessioni con domini di legame PDZ. Il dominio C-terminale intracellulare di claudina possiede molteplici siti regolatori, come possibili siti di fosforilazione di serina e di theronine e nomi di dominio di associazione PDZ. La fosforilazione delle claudine-3 e -4 nelle cellule tumorali della prostata è strettamente connessa alla regolazione della permeabilità paracellulare. A titolo di esempio, i pazienti con pseudoipoaldosteronismo di tipo II (PHA II o sindrome da shunt vitaminico) presentano acidosi metabolica iperecemica, ipertensione e trasporto di ioni paracellulari disregolati. La base molecolare è collegata a una mutazione con perdita di funzione dalle serin-treonine chinasi, WNK1 e WNK4, che regolano i cotrasportatori di cloruro epiteliale. Ciò contribuisce anche ad un aumento della fosforilazione di entrambe le claudine-1-4 e un aumento della permeabilità paracellulare. Molte vie di segnalazione sono implicate nella fosforilazione di claudine come PKC, Rho GTPases, protein chinasi mitogene-attivate (MAPK) e fosfatasi. La fosforilazione MAPK di claudina-1 è necessaria per la funzione di barriera mediata da claudina-1. Inoltre, claudins-1, -2, -7, -8, -16 e -17 hanno putativi siti web sulla fosforilazione di PKC.
Tutte le claudine, ad eccezione della claudina-12, che completano la disposizione dipeptidica YV, che ha dimostrato di interagire con i domini di legame PDZ comprendono ZO-1, -2 e -3, il nome di dominio multi-PDZ e la proteina TJ associata a PALS1, secondo Figura 3. Molte di queste proteine di scaffolding contengono diversi domini PDZ, che facilitano l'introduzione di complessi proteici localizzati densi, chiamati anche "placche citoplasmatiche". Inoltre, le proteine di scaffolding possono interagire con molecole di segnalazione, come proteine leganti GTP eterodimeriche (Rab13 e G? 12), fattori trascrizionali e variabili di elaborazione dell'RNA, per collegare i complessi TJ all'actina-citoscheletro e modulare gli aspetti della polarizzazione surrenale, differenziazione e funzione barriera.
Molecole di adesione giunzionali (JAM)
Le molecole di adesione giunzionali sono proteine di membrana integrali che appartengono alla superfamiglia delle immunoglobuline e hanno due pieghe di immunoglobulina, il tipo VH e C2, dal dominio extracellulare. I JAM sono espressi da più tipi di cellule, incluse le cellule epiteliali, endoteliali e immunitarie. Sono suddivisi in base all'espressione dei temi di legame PDZ di Tipo I o II nel C-terminale intracellulare, il che implica che i due tipi interagiscono con impalcature eccezionali e proteine citoplasmatiche. JAM-A, -B e -C (o JAM1-3) hanno soggetti leganti di tipo II, mentre i JAM atipici, come JAM-4, coxsackie e adenovirus (CAR) e la molecola di adesione selettiva endoteliale costituiscono PDZ di tipo I- domini vincolanti. Paragonabili alle proteine TJ aggiuntive, queste interazioni JAM-PDZ forniscono l'ancoraggio al citoscheletro di actina, secondo la Figura 3.
La regione extracellulare di JAM si adatta a ligandi multipli attraverso interazioni omofiliche ed eterofili, che possono essere proposte per regolare le funzioni mobili e la permeabilità paracellulare delle JAM. Le interazioni omofiliche JAM-A o -B governano la creazione di TJs operativi e la formazione del confine tra cellule, mentre le interazioni JAM eterofiliche giocano un ruolo nell'adesione delle cellule leucocitarie-endoteliali.
Studi recenti dimostrano il significato di JAM-A nella formazione e nell'assemblaggio di TJ nelle cellule epiteliali intestinali. Downregulation SiRNA di JAM-A a cellule epiteliali SK-C015 innescato un aumento della permeabilità. Coerentemente con questo, i topi JAM-A avevano aumentato la permeabilità della mucosa come indicato dal miglioramento del flusso di destrano e diminuzione del TER. Tuttavia, questi topi hanno anche avuto un aumento dell'espressione di claudina-10 e -15, che si ritiene modifichino i pori selettivi dal complesso TJ, migliorando la permeabilità paracellulare. È interessante notare che i topi JAM-A hanno aumentato la suscettibilità alla colite indotta da sostanze chimiche. La somministrazione di destrano sodio solfato a topi JAM-A ha indotto un danno al colon più acuto rispetto agli animali di controllo WT. Questi studi implicano alterata permeabilità intestinale per un fattore di suscettibilità al disturbo autoimmune.
Le informazioni di cui sopra sono evidence-based. Lo scopo delle nostre informazioni è limitato alle lesioni e alle condizioni chiropratiche e spinali. Per discutere l'argomento, non esitate a chiedere al Dr. Jimenez o contattaci a 915-850-0900 .
Dott. Alex Jimenez

Ulteriori argomenti: Benessere
La salute generale e il benessere sono essenziali per mantenere il giusto equilibrio mentale e fisico nel corpo. Dando una nutrizione equilibrata, esercitando e partecipando alle attività fisiche, a dormire regolarmente una sana quantità di tempo, seguendo i migliori suggerimenti per la salute e il benessere può in ultima analisi contribuire a mantenere il benessere complessivo. Mangiare un sacco di frutta e verdura può andare un lungo cammino per aiutare le persone a diventare sane.

ARGOMENTO DI TENDENZA: EXTRA EXTRA: Come diventare più sano!
Le informazioni qui riportate su "Struttura complessa e funzione di giunzione nel tratto GI" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale