Estratto nutraceutico:
La biologia vascolare, la muscolatura liscia endoteliale e vascolare e la disfunzione cardiaca giocano un ruolo primario nell'iniziazione e perpetuazione dell'ipertensione, delle malattie cardiovascolari e dei danni agli organi bersaglio. Le interazioni nutritive e l'epigenetica sono fattori predominanti nel promuovere effetti benefici o dannosi nella salute cardiovascolare e nell'ipertensione. Macronutrienti e micronutrienti possono prevenire, controllare e trattare l'ipertensione attraverso numerosi meccanismi legati alla biologia vascolare. Lo stress ossidativo, l'infiammazione e la disfunzione autoimmune iniziano e propagano l'ipertensione e le malattie cardiovascolari. Vi è un ruolo per l'uso selezionato di integratori nutraceutici singoli e componenti, vitamine, antiossidanti e minerali nel trattamento dell'ipertensione sulla base di studi scientificamente controllati che integrano un'alimentazione ottimale, insieme ad altre modificazioni dello stile di vita.
Parole chiave: Ipertensione; Nutrizione; Supplementi nutrizionali;
Malattia cardiovascolare; Biologia vascolare
Consiglio di base: Biologia vascolare e disfunzione endoteliale
svolgere un ruolo primario nell'ipertensione e nelle successive malattie cardiovascolari. Micronutrienti, macronutrienti e nutrizione ottimale e supplementi nutrizionali possono
prevenire, controllare e trattare l'ipertensione attraverso numerosi meccanismi legati alla biologia vascolare. Questi trattamenti sono complementari alla terapia farmacologica. ossidativo
lo stress, l'infiammazione e la disfunzione autoimmune iniziano e propagano l'ipertensione e le malattie cardiovascolari. Vi è un ruolo per l'uso selezionato di integratori nutraceutici singoli e componenti, vitamine, antiossidanti e minerali nel trattamento dell'ipertensione sulla base di studi scientificamente controllati che integrano un'alimentazione ottimale, insieme ad altre modificazioni dello stile di vita.
Contenuti
Introduzione nutraceutica:
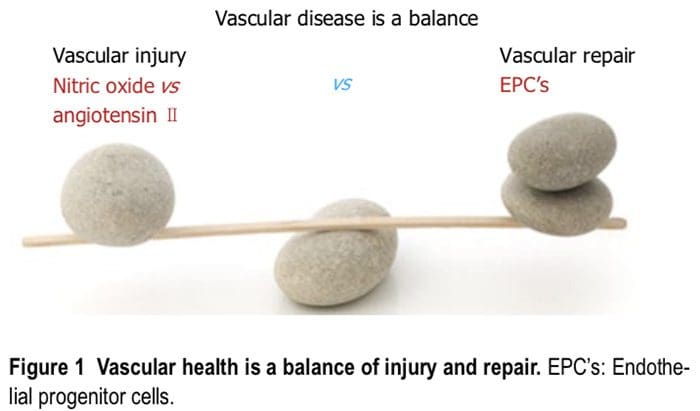
La malattia vascolare è un equilibrio tra danno vascolare e riparazione (Figura 1). L'endotelio si trova in una posizione strategica tra il sangue e la muscolatura vascolare liscia
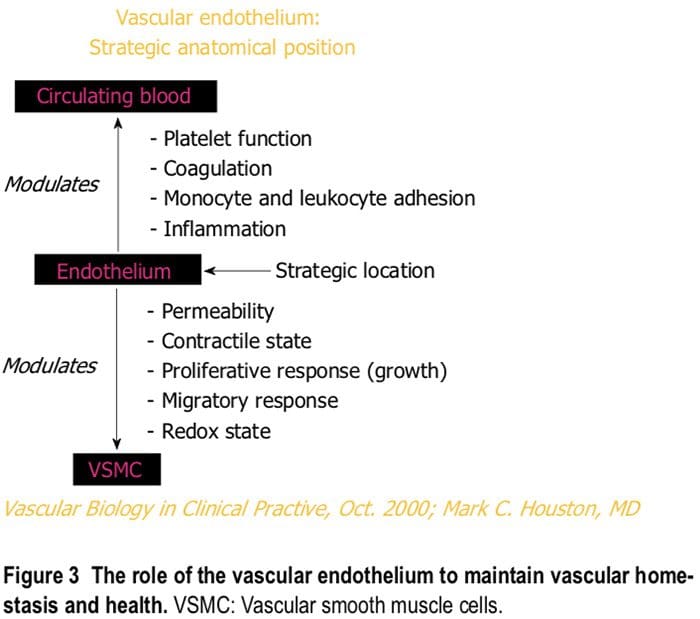
e secerne varie sostanze per mantenere l'omeostasi e la salute vascolare (Figure 2 e 3). Vari insulti che danneggiano l'endotelio portano a disfunzione endoteliale
(ED) e può indurre ipertensione e altre malattie cardiovascolari. L'ipertensione può essere un marker emodinamico dell'endotelio ferito e della muscolatura liscia vascolare correlata alle risposte finite dell'infiammazione, dello stress ossidativo e della disfunzione immunitaria delle arterie che portano a disfunzione muscolare, vascolare e cardiaca liscia, perdita di elasticità arteriosa con ridotta compliance arteriosa e aumento sistemico resistenza vascolare. Ipertensione
è una conseguenza dell'interazione tra genetica e ambiente. Macronutrienti e micronutrienti sono cruciali nella regolazione della pressione sanguigna (BP) e del successivo danno d'organo bersaglio (TOD). Le interazioni gene-nutrienti, la successiva espressione genica, l'epigenetica, lo stress ossidativo, l'infiammazione e la disfunzione vascolare autoimmune hanno influenze positive o negative sulla biologia vascolare nell'uomo. L'attivazione endoteliale con disfunzione erettile e la disfunzione della muscolatura liscia vascolare (VSMD) avvia e perpetua l'ipertensione essenziale.
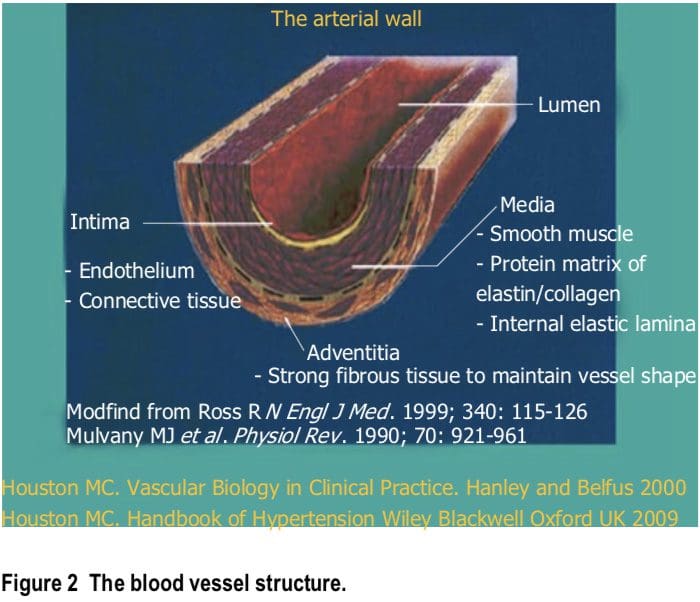
 Le carenze di macronutrienti e di micronutrienti sono molto comuni nella popolazione generale e possono essere ancora più comuni nei pazienti con ipertensione e cardiovascolari
Le carenze di macronutrienti e di micronutrienti sono molto comuni nella popolazione generale e possono essere ancora più comuni nei pazienti con ipertensione e cardiovascolari
malattia dovuta alla genetica, alle cause ambientali e all'uso di droghe prescritte. Queste carenze avranno un impatto enorme sul presente e sul futuro cardiovascolare
esiti di salute come ipertensione, infarto miocardico (MI), ictus e malattia renale. La diagnosi e il trattamento di queste carenze nutrizionali ridurranno la BP
e migliorare la salute vascolare, l'ED, la biologia vascolare e gli eventi cardiovascolari.
EPIDEMIOLOGIA
L'epidemiologia sottolinea il ruolo etiologico della dieta e dell'assunzione di nutrienti associati all'ipertensione. La transizione dalla dieta paleolitica alla nostra dieta moderna ha prodotto
un'epidemia di malattie correlate alla nutrizione (Tabella 1). Ipertensione, aterosclerosi, malattia coronarica (CHD), infarto miocardico, insufficienza cardiaca congestizia (CHF), cerebrovascolare
incidenti (CVA), malattie renali, tipo 2 diabete mellito (T2DM), sindrome metabolica (SM) e obesità sono alcune di queste malattie [1,2]. Tabella 1 contrasta l'assunzione di nutrienti coinvolti nella regolazione della pressione sanguigna durante l'era paleolitica e il tempo moderno. L'evoluzione da un ambiente pre-agricolo, da cacciatore-raccoglitore a una società agricola e di refrigerazione ha imposto un processo di selezione nutrizionale innaturale e malsano. In breve, la dieta è cambiata più di quanto la nostra genetica possa adattarsi.
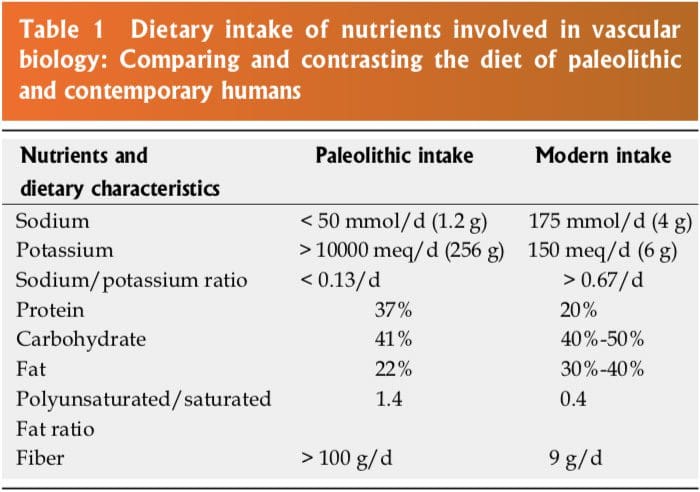 Il patrimonio genetico umano è 99.9% quello dei nostri antenati paleolitici, tuttavia le nostre prese nutrizionali, vitaminiche e minerali sono molto diverse [3]. Le variazioni dei macronutrienti e dei micronutrienti, lo stress ossidativo delle specie di radicali dell'ossigeno (ROS) e dell'azoto radicale (RNS) e i mediatori dell'infiammazione come le molecole di adesione cellulare (CAM), le citochine, le molecole di segnalazione e la disfunzione vascolare autoimmune delle cellule T e B contribuiscono
Il patrimonio genetico umano è 99.9% quello dei nostri antenati paleolitici, tuttavia le nostre prese nutrizionali, vitaminiche e minerali sono molto diverse [3]. Le variazioni dei macronutrienti e dei micronutrienti, lo stress ossidativo delle specie di radicali dell'ossigeno (ROS) e dell'azoto radicale (RNS) e i mediatori dell'infiammazione come le molecole di adesione cellulare (CAM), le citochine, le molecole di segnalazione e la disfunzione vascolare autoimmune delle cellule T e B contribuiscono
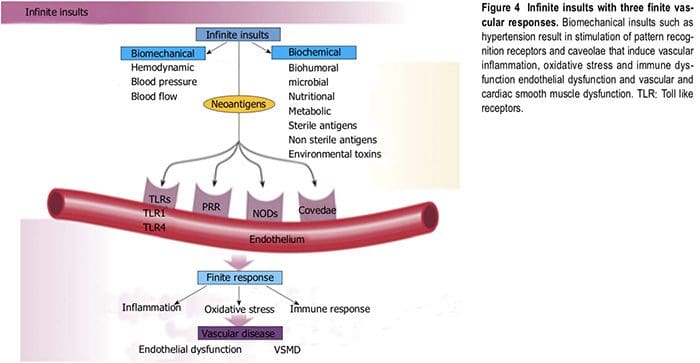
alla maggiore incidenza di ipertensione e altre malattie cardiovascolari attraverso complesse interazioni gene-nutrienti, interazioni epigenetiche e nutrienti-caveole e reazioni di nutrienti con recettori di riconoscimento di pattern [toll like receptors (TLR) e nod like receptors] nell'endotelio[4-9] (Figura 4). Riduzione della biodisponibilità dell'ossido nitrico, aumento dell'angiotensina ? e l'endotelina accoppiata con l'attivazione endoteliale avviano la disfunzione vascolare e cardiaca e l'ipertensione. La cattiva alimentazione, insieme all'obesità e a uno stile di vita sedentario, hanno portato a un aumento esponenziale dei fattori nutrizionali correlati
malattie. In particolare, l'elevato rapporto Na + / K + delle diete moderne ha contribuito all'ipertensione, CVA, CHD, MI, CHF e malattia renale [3,10] così come l'assunzione relativamente bassa
di omega-3 PUFA, aumento di omega-6 PUFA, grassi saturi e acidi grassi trans [11].
 FISIOPATOLOGIA
FISIOPATOLOGIA
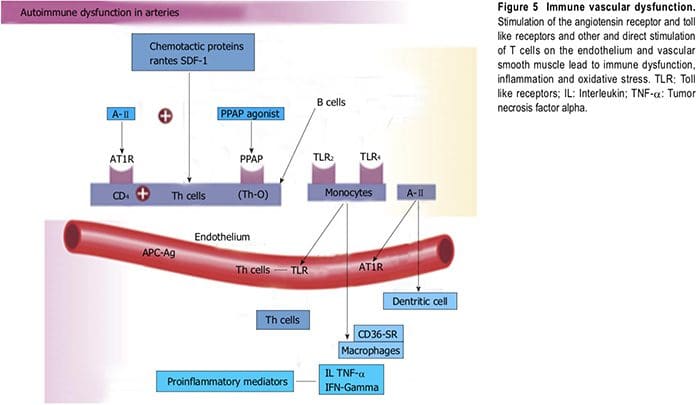
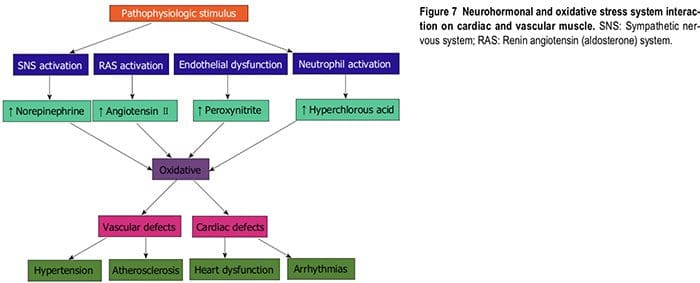
La biologia vascolare assume un ruolo fondamentale nell'iniziare e perpetuare l'ipertensione e la TOD cardiovascolare[1]. Lo stress ossidativo (ROS e RNS), l'infiammazione (aumento dell'espressione di geni proinfiammatori redox-sensibili, CAM e migrazione di reclutamento e infiltrazione di cellule circolanti) e la disfunzione vascolare autoimmune (cellule T e cellule B) sono i principali meccanismi fisiopatologici e funzionali che inducono malattia vascolare[1,12-14] (Figura 5). Tutti e tre questi sono strettamente correlati e stabiliscono una combinazione mortale che porta a disfunzione erettile, muscolatura liscia vascolare e disfunzione cardiaca, ipertensione, malattie vascolari, aterosclerosi e CVD. L'ipertensione non è una malattia ma è la risposta corretta e cronicamente disregolata con esito esagerato degli infiniti insulti al vaso sanguigno con conseguente espressione genetico-ambientale
schemi e disturbi a valle in cui il sistema vascolare è l'astante innocente. Questa diventa una risposta vascolare disadattiva che inizialmente era intesa
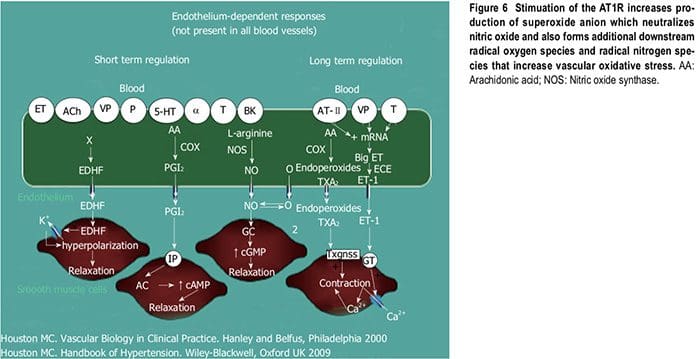
per fornire difesa vascolare agli insulti endoteliali (Figura 6) [1,13-15]. L'ipertensione è una vasculopatia caratterizzata da ED, rimodellamento strutturale, infiammazione vascolare, aumento della rigidità arteriosa, ridotta distensibilità e perdita di elasticità [13]. Questi insulti sono biomeccanici (BP, pressione del polso, flusso sanguigno, flusso oscillatorio, turbolenza, aumento, velocità dell'onda del polso e onde riflesse) e bioumorale o biochimico che include tutte le cause non meccaniche come metaboliche, endocrine, nutrizionali, tossiche, infettive e altre eziologie [1] (Figura 4). Oltre alle connessioni molto consolidate per le cause endocrine e nutrizionali dell'ipertensione, le tossine e le infezioni aumentano anche la PA [16-20]. Diverse tossine come bifenili policlorurati, mercurio, piombo, cadmio, arsenico e ferro aumentano anche la BP e la CVD [16,17].
 Numerosi organismi microbici sono stati implicati nell'ipertensione e nella CHD [18-20]. Tutti questi insulti portano a compromissione della struttura e della funzione microvascolare che si manifesta clinicamente come ipertensione [12-14]. Il livello di PA potrebbe non fornire un'indicazione accurata del coinvolgimento microvascolare e della compromissione dell'ipertensione. I pazienti ipertesi hanno una microvascolarizzazione anomala sotto forma di rimodellamento eutrofico verso l'interno delle arterie di piccola resistenza che portano ad alterata capacità vasodilatatoria, aumento della resistenza vascolare, aumento del rapporto tra i media e il lume, diminuzione della perfusione massima dell'organo e riduzione della riserva di flusso, specialmente nel cuore con diminuzione del flusso coronarico riserva [12-14]. Significativa compromissione funzionale microvascolare strutturale si verifica anche prima che la PA inizi a crescere nella prole normotensiva di genitori ipertesi evidenziata da ED, alterata vasodilatazione, resistenza vascolare all'avambraccio, disfunzione diastolica, aumento dell'indice di massa ventricolare sinistro, spessore del setto e della parete posteriore superiore e ipertrofia ventricolare sinistra [12,15]. Pertanto, i processi cellulari alla base delle perturbazioni vascolari costituiscono un fenotipo vascolare dell'ipertensione che può essere determinato dalla vita precoce
Numerosi organismi microbici sono stati implicati nell'ipertensione e nella CHD [18-20]. Tutti questi insulti portano a compromissione della struttura e della funzione microvascolare che si manifesta clinicamente come ipertensione [12-14]. Il livello di PA potrebbe non fornire un'indicazione accurata del coinvolgimento microvascolare e della compromissione dell'ipertensione. I pazienti ipertesi hanno una microvascolarizzazione anomala sotto forma di rimodellamento eutrofico verso l'interno delle arterie di piccola resistenza che portano ad alterata capacità vasodilatatoria, aumento della resistenza vascolare, aumento del rapporto tra i media e il lume, diminuzione della perfusione massima dell'organo e riduzione della riserva di flusso, specialmente nel cuore con diminuzione del flusso coronarico riserva [12-14]. Significativa compromissione funzionale microvascolare strutturale si verifica anche prima che la PA inizi a crescere nella prole normotensiva di genitori ipertesi evidenziata da ED, alterata vasodilatazione, resistenza vascolare all'avambraccio, disfunzione diastolica, aumento dell'indice di massa ventricolare sinistro, spessore del setto e della parete posteriore superiore e ipertrofia ventricolare sinistra [12,15]. Pertanto, i processi cellulari alla base delle perturbazioni vascolari costituiscono un fenotipo vascolare dell'ipertensione che può essere determinato dalla vita precoce
programmazione e imprinting che è aggravata dall'invecchiamento vascolare [12-14].
Lo stress ossidativo
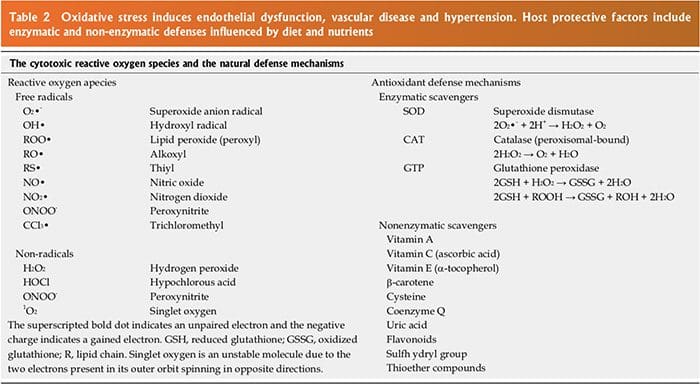
Lo stress ossidativo, con uno squilibrio tra ROS e RNS ed i meccanismi di difesa antiossidante, contribuisce all'eziologia dell'ipertensione negli animali[10] e nell'uomo[11,12]. Le specie radicaliche dell'ossigeno e l'RNS sono generate da molteplici fonti cellulari, tra cui la nicotinammide adenina dinucleotide fosfato idrasi (NADPH) ossidasi,
mitocondri, xantina ossidasi, ossido nitrico (NO) sintasi disaccoppiato derivato dall'endotelio (U-eNOS), cicloossigenasi e lipo-ossigenasi[11]. L'anione superossido è la specie di ROS predominante prodotta da questi tessuti, che neutralizza l'NO e porta anche alla produzione a valle di altri ROS (Figura 3). I pazienti ipertesi presentano meccanismi di difesa antiossidante endogeni ed esogeni[21], un aumento dello stress ossidativo plasmatico e una risposta esagerata allo stress ossidativo a vari stimoli[21,22]. I soggetti ipertesi hanno anche una capacità plasmatica di riduzione del ferro plasma più bassa, livelli di vitamina C più bassi e un aumento degli 8-isoprostani plasmatici, che sono correlati sia con la pressione sistolica che diastolica. Vari polimorfismi a singolo nucleotide (SNP) nei geni che codificano per gli enzimi antiossidanti sono direttamente correlati all'ipertensione[23]. Questi includono NADPH ossidasi, xantina
ossidasi, superossido dismutasi 3 (SOD 3), catalasi, glutatione perossidasi 1 (GPx 1) e tioredossina. La carenza di antiossidanti e l'eccessiva produzione di radicali liberi sono stati implicati nell'ipertensione umana in numerosi studi epidemiologici, osservazionali e interventistici
(Tabella 2) [21,22,24]. Le specie di ossigeno radicale danneggiano direttamente le cellule endoteliali, degradano NO, influenzano il metabolismo degli eicosanoidi, ossidano le LDL, i lipidi, le proteine, i carboidrati, il DNA e le molecole organiche, aumentano le catecolamine, danneggiano il macchinario genetico, influenzano l'espressione genica ei fattori di trascrizione [1,21,22,25,26]. Le inter-relazioni tra i sistemi neuro-ormonali, lo stress ossidativo e le malattie cardiovascolari sono mostrate nelle Figure 6 e 7. L'aumento dello stress ossidativo, dell'infiammazione e della disfunzione vascolare autoimmune nell'ipertensione umana deriva da una combinazione di aumento della generazione di ROS e RNS, un
risposta esacerbata a ROS e RNS e una diminuzione della riserva antiossidante [24-29]. L'aumento dello stress ossidativo nel midollo ventrolaterale rostrale (RVLM) aumenta gli input eccitatori glutamatergici e attenua gli input inibitori GABA-ergici al RVLM che contribuisce ad aumentare l'attività del sistema nervoso simpatico (SNS) dal nucleo paraventricolare [30]. L'attivazione di AT1R nel RVLM aumenta la NADPH ossidasi e aumenta lo stress ossidativo e l'anione superossido, aumenta il deflusso di SNS causando uno squilibrio dell'attività SNS / PNS con aumento della PA, aumento della frequenza cardiaca e alterazioni in
variabilità della frequenza cardiaca e tempo di recupero della frequenza cardiaca, che può essere bloccato dai bloccanti AT1R [30,31].
 Infiammazione
Infiammazione
Il legame tra infiammazione e ipertensione è stato suggerito sia negli studi trasversali che longitudinali [32]. Aumento della proteina C-reattiva ad alta sensibilità
(HS-CRP) così come altre citochine infiammatorie come interleuchina-1B, (IL-1B), IL-6, necrosi tumorale alfa (TNF-?) e leucocitosi cronica si verificano nell'ipertensione e nei TOD correlati all'ipertensione, come l'aumento IMT carotideo[33]. HS-CRP predice eventi CV futuri[32,33]. Un'elevata PCR HS è sia un marker di rischio che un fattore di rischio per l'ipertensione e le malattie cardiovascolari[34,35]. Aumenti di HS-CRP superiori a 3 µg/ml possono aumentare la PA in pochi giorni, il che è direttamente proporzionale all'aumento di HS-CRP[34,35]. L'ossido nitrico e l'eNOS sono inibiti da HS-CRP[34,35]. L'AT2R, che normalmente controbilancia AT1R, è downregolato da HS-CRP[34,35]. angiotensina? (A-?) sovraregola molte delle citochine, in particolare IL-6, CAM e chemochine attivando il fattore nucleare Kappa B (NF? b)
portando alla vasocostrizione. Questi eventi, insieme agli aumenti dello stress ossidativo e dell'endotelina-1, elevano la PA [32].
Disfunzione autoimmune
Le risposte immunitarie innate e adattative sono collegate all'ipertensione e alla CVD indotta da ipertensione attraverso almeno tre meccanismi: produzione di citochine, nervosismo centrale
stimolazione del sistema e danno renale. Ciò include l'ipertensione sensibile al sale con aumento dell'infiammazione renale a causa dello squilibrio di cellule T, disregolazione di CD4 +
e CD8 + linfociti e leucocitosi cronica con aumento dei neutrofili e riduzione dei linfociti [36-38]. Leucocitosi, in particolare aumento dei neutrofili e diminuzione
il conteggio dei linfociti aumenta la pressione sanguigna nei neri con 6 / 2 mmHg nel terzile più alto e più basso [38]. I macrofagi e vari sottotipi di cellule T regolano la BP, invadono l'arteriosa
parete, attivano i TLR e inducono danno vascolare autoimmune[38,39]. angiotensina? attiva le cellule immunitarie (cellule T, macrofagi e cellule dendritiche) e promuove la cellula
infiltrazione negli organi bersaglio[39]. I linfociti T CD4+ esprimono i recettori AT1R e PPAR gamma e rilasciano TNF-?, interferone e interleuchine all'interno della parete vascolare quando attivati[39] (Figura 5). L'IL-17 prodotta dalle cellule T può svolgere un ruolo fondamentale nella genesi dell'ipertensione causata dall'angiotensina ?[39]. I pazienti ipertesi hanno un mRNA di TLR 4 significativamente più alto nei monociti rispetto al normale[40]. Riduzione intensiva della pressione arteriosa a sistolica
La PA (SBP) inferiore a 130 mmHg rispetto alla SBP a soli 140 mmHg riduce ulteriormente il TLR 4[40]. UN-? attiva l'espressione del TLR portando all'infiammazione e all'attivazione del sistema immunitario innato. Quando TLR 4 è attivato, si verificano attivazione dei macrofagi a valle, migrazione, aumento della metalloproteinasi 9, rimodellamento vascolare, accumulo di collagene nell'arteria, LVH e fibrosi cardiaca[40]. Il sistema nervoso autonomo è critico sia in aumento
o riduzione della disfunzione immunitaria e dell'infiammazione [41]. Vie anti infiammatorie colinergiche efferenti attraverso il nervo vagale innervano la milza, la nicotina acetilcolina
subunità del recettore e citochine che producono cellule immunitarie per influenzare la vasocostrizione e la BP [41]. L'infiammazione locale del SNC o l'ischemia possono mediare l'infiammazione vascolare e l'ipertensione [39].
L'aldosterone è associato ad una maggiore immunità adattativa e risposte autoimmuni con l'attivazione delle cellule T CD4+ e la polarizzazione Th 17 con aumento di IL 17, TGF-? e TNF-? che modulano oltre 30 geni infiammatori[42,43]. L'aumento dell'aldosterone sierico è un
fattore di rischio indipendente per CVD e CHD attraverso effetti non emodinamici e aumento della PA [42,43]. Il blocco dei recettori mineralcorticoidi nel cuore, nel cervello, nei vasi sanguigni e nelle cellule immunitarie riduce il rischio CV anche con la persistenza dell'ipertensione [42,43].
TRATTAMENTO
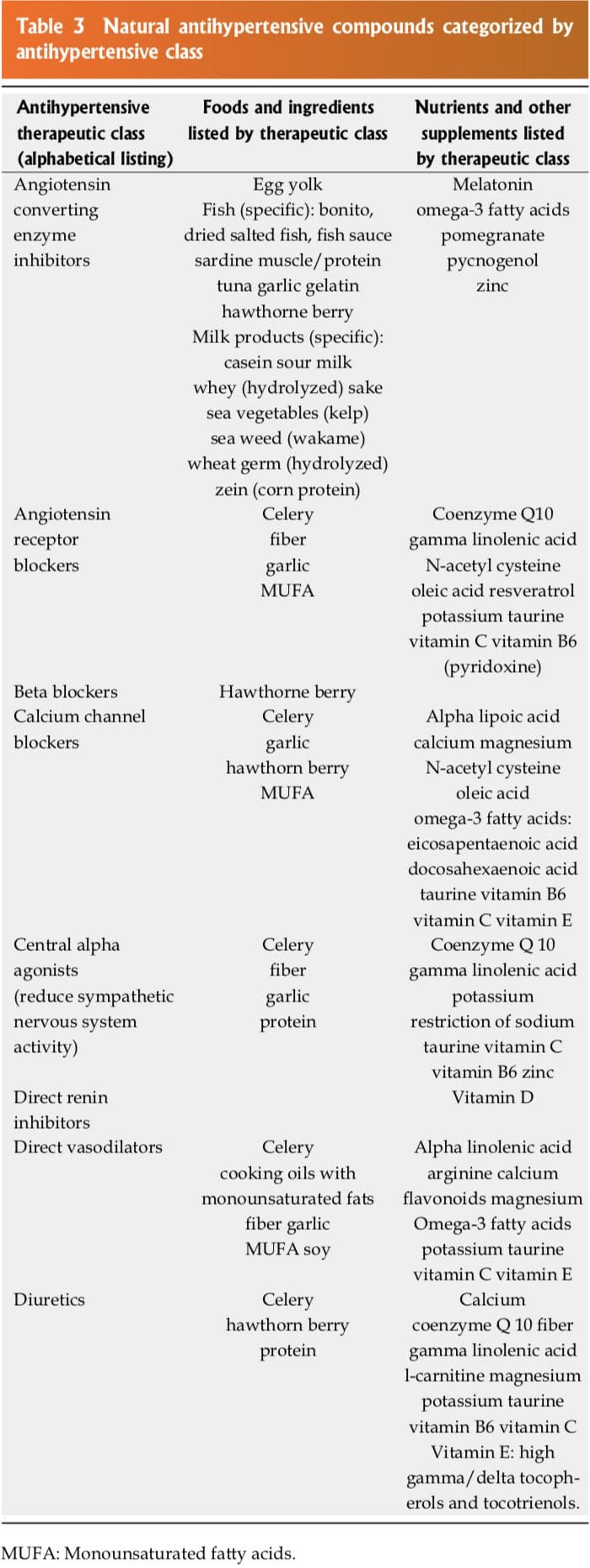
Molti dei composti naturali presenti nel cibo, alcuni integratori nutraceutici, vitamine, antiossidanti o minerali funzionano in modo simile a una specifica classe di antipertensivi
farmaci. Sebbene la potenza di questi composti naturali possa essere inferiore al farmaco antipertensivo, se usato in combinazione con altri nutrienti e nutraceutici
integratori, l'effetto antipertensivo è additivo o sinergico. La tabella 3 riassume questi composti naturali nelle principali classi di farmaci antipertensivi come diuretici, beta-bloccanti, alfa agonisti centrali, vasodilatatori diretti, calcio-antagonisti (CCB), inibitori dell'enzima di conversione dell'angiotensina (ACEI), bloccanti del recettore dell'angiotensina (ARB). s) e inibitori diretti della renina (DRI).
 Approcci dietetici per fermare le diete ipertensione
Approcci dietetici per fermare le diete ipertensione
Gli approcci dietetici per fermare l'ipertensione (DASH) ?e ? le diete hanno dimostrato in modo conclusivo riduzioni significative della PA in pazienti borderline e ipertesi allo stadio[44,45]. Nei soggetti ipertesi DASH non trattati con SBP < 160 mmHg e DBP 80-95 mmHg sono stati sottoposti a una delle tre diete per 4 settimane, dieta di controllo, dieta a base di frutta e verdura (F + V) e dieta combinata che ha aggiunto F + V e bassa latticini grassi[44]. TRATTINO ? aggiunta progressiva restrizione del sodio in ciascun gruppo[45]. La dieta di controllo consisteva in sodio a 3 g/die, potassio, magnesio e calcio al 25% della media USA, macronutrienti alla media USA di 4 porzioni al giorno, un rapporto sodio/potassio di 1.7 e fibre a 9 g/die. La dieta F + V ha aumentato il potassio, il magnesio e il calcio al 75%, i macronutrienti a un valore superiore alla media degli Stati Uniti, un rapporto sodio potassio di 0.7, 31 g di fibre e 8.5 porzioni di frutta e verdura al giorno. La dieta combinata era simile alla dieta F + V ma aggiungeva latticini a basso contenuto di grassi. A 2 settimane la pressione arteriosa era diminuita di 10.7/5.2 mmHg nei pazienti ipertesi in DASH? e 11.5/6.8 mmHg nei pazienti ipertesi in DASH?. Queste riduzioni persistevano finché i pazienti erano a dieta. La dieta DASH aumenta l'attività della renina plasmatica (PRA) ei livelli sierici di aldosterone in risposta alla riduzione della pressione arteriosa[46,47]. L'aumento medio della PRA è stato di 37 ng/ml al giorno[47]. C'era un'associazione di risposta con il polimorfismo G46A del recettore adrenergico beta 2. L'allele A di G46A ha avuto una maggiore riduzione della PA e smussato PRA e aldosterone. Il genotipo dell'acido arachidonico (AA) ha avuto la risposta migliore e il genotipo GG non ha avuto risposta. L'aggiunta di un ARB, ACEI o DRI ha migliorato la risposta pressoria alla dieta DASH nel gruppo GG a causa del blocco dell'aumento del PRA. Una dieta DASH a basso contenuto di sodio riduce lo stress ossidativo (urine F2-isoprostani), migliora la funzione vascolare (indice di aumento) e abbassa la pressione arteriosa nei soggetti sensibili al sale[48]. Inoltre, il nitrito plasmatico è aumentato e la velocità dell'onda del polso è diminuita alla seconda settimana della dieta DASH[49].
Riduzione del sodio (Na +)
L'assunzione media di sodio negli Stati Uniti è di 5000 mg/die con alcune aree del paese che consumano 15000-20000 mg/die[50]. Tuttavia, il fabbisogno minimo di sodio è probabilmente di circa 500 mg/die[50]. Studi clinici epidemiologici, osservazionali e controllati dimostrano che un aumento dell'assunzione di sodio è associato a una pressione arteriosa più elevata nonché a un aumento del rischio di CVD, CVA, LVH, CHD, IM, insufficienza renale, proteinuria e iperattività del SNS[1,50]. Una riduzione dell'assunzione di sodio nei pazienti ipertesi, in particolare i pazienti sensibili al sale, abbasserà significativamente la pressione arteriosa di 4-6/2-3 mmHg che è proporzionale al grado di restrizione di sodio e può prevenire o ritardare l'ipertensione nei pazienti ad alto rischio e ridurre il futuro Eventi CV[51-53].
La sensibilità al sale (aumento del MAP del 10% con carico di sale) si verifica in circa il 51% dei pazienti ipertesi ed è un fattore chiave nel determinare le risposte cardiovascolari, cerebrovascolari, renali e pressorie all'assunzione di sale con la dieta[54]. Gli eventi cardiovascolari sono più comuni nei pazienti sensibili al sale rispetto a quelli resistenti al sale, indipendentemente dalla PA[55]. Un aumento dell'assunzione di sodio ha una correlazione positiva diretta con la pressione arteriosa e il rischio di CVA e CHD[56]. Il rischio è indipendente dalla PA per CVA con un rischio relativo compreso tra 1.04 e 1.25 dal quartile più basso a quello più alto[56]. Inoltre, i pazienti si convertiranno a un pattern di PA non dipping con aumenti della PA notturna all'aumentare dell'assunzione di sodio[56].
L'aumento dell'assunzione di sodio ha un effetto negativo diretto sulle cellule endoteliali[57-61]. Il sodio favorisce la linfangiogenesi cutanea, aumenta la rigidità delle cellule endoteliali, riduce le dimensioni, l'area superficiale, il volume, il citoscheletro, la deformabilità e la flessibilità, riduce la produzione di eNOS e NO, aumenta la dimetilarginina asimmetrica (ADMA), lo stress ossidativo e il TGF-?. Tutte queste risposte vascolari anormali sono aumentate in presenza di aldosterone[57-61]. Questi cambiamenti si verificano indipendentemente dalla pressione arteriosa e possono essere parzialmente neutralizzati dal potassio alimentare[57-61]. Le cellule endoteliali agiscono come sensori del sale vascolare[62]. Le cellule endoteliali sono bersagli per l'aldosterone che attivano i canali epiteliali del sodio (ENaC) e hanno effetti negativi sul rilascio di NO e sulla funzione endoteliale. La rigidità meccanica della membrana plasmatica cellulare e la rete di actina sottomembranosa (gliciocalice endoteliale) ( guscio ) fungono da firewall per proteggere le cellule endoteliali e sono regolati da sodio, potassio e aldosterone sierici entro il range fisiologico[62] . I cambiamenti nell'attività dipendente dallo stress da taglio dell'NO sintasi endoteliale situata nelle caveole regolano la viscosità in questo "guscio"[62]. L'alto livello di sodio plasmatico gelifica l'involucro della cellula endoteliale, mentre l'involucro è fluidificato dall'alto contenuto di potassio. Queste comunicazioni tra ioni extracellulari ed enzimi intracellulari avvengono alla barriera della membrana plasmatica, mentre il 90% della massa cellulare totale rimane non coinvolta in questi cambiamenti. Il blocco dell'ENaC con spironolattone (100%) o amiloride (84%) riduce al minimo o arresta molte di queste risposte endoteliali vascolari e aumenta l'NO[58,63]. Il rilascio di ossido nitrico segue la nanomeccanica endoteliale e non viceversa e la depolarizzazione della membrana riduce la rigidità delle cellule endoteliali vascolari migliorando la vasodilatazione dipendente dal flusso ossido nitrico[64,65]. In presenza di infiammazione vascolare e aumento dell'HS-CRP, gli effetti dell'aldosterone sull'ENaC vengono potenziati aumentando ulteriormente la rigidità vascolare e la pressione arteriosa[66]. Un'elevata assunzione di sodio abolisce immediatamente anche la vasodilatazione mediata da AT2R con la completa abolizione della vasodilatazione endoteliale (EDV) entro 30 giorni[67]. Pertanto, è diventato chiaro che l'aumento del sodio nella dieta ha effetti negativi sul sistema vascolare, pressione arteriosa e CVD alterando il glicocalice endoteliale, che è un biopolimero caricato negativamente che riveste i vasi sanguigni e funge da barriera protettiva contro il sovraccarico di sodio, l'aumento del sodio permeabilità e TOD indotta dal sodio[68]. Alcuni SNP della chinasi inducibile dal sale, che alterano l'ATPasi Na+ /K+, determinano l'ipertensione indotta dal sodio e la LVH[69].
L'assunzione giornaliera di sodio in pazienti ipertesi deve essere compresa tra 1500 e 2000 mg. La restrizione di sodio migliora la riduzione della pressione arteriosa nei pazienti sottoposti a trattamento farmacologico e la diminuzione della PA è additiva con la restrizione dei carboidrati raffinati [70,71]. Ridurre l'assunzione di sodio nella dieta può ridurre il danno al cervello, al cuore, ai reni e ai vasi attraverso meccanismi dipendenti dalla ridotta riduzione della PA e da quelli indipendenti dalla diminuzione della PA [72-75].
Un equilibrio di sodio con altri nutrienti, specialmente potassio, magnesio e calcio è importante, non solo nel ridurre e controllare la pressione arteriosa, ma anche nel ridurre gli eventi cardiovascolari e cerebrovascolari [3,72,73]. Un aumento del rapporto sodio / potassio è associato ad un aumento significativo del rischio di CVD e di mortalità per tutte le cause [72]. Gli indiani Yanomamo consumano ed escono solo 1 meq di sodio in 24 h e consumano ed espellono 152 meq di potassio in 24 h [73]. Il rapporto Na + a K + è 1 / 152 ed è associato a PRA elevato, ma BP non aumenta con l'età. All'età 50 la PA media nello Yanomamo è 100-108 / 64-69 mmHg [73].
Potassio
L'apporto alimentare medio di potassio (K +) negli Stati Uniti è di 45 mmol / d con un rapporto potassio / sodio (K + / Na +) inferiore a 1: 2 [10,74]. L'assunzione raccomandata di K + è di 4700 mg / d (120 mmol) con un rapporto K + / Na + di circa 4-5 a 1 [10,74]. Numerosi studi epidemiologici, osservazionali e clinici hanno dimostrato una significativa riduzione della pressione arteriosa con un aumento dell'assunzione di K + nella dieta sia in pazienti normotesi che ipertesi [10,74,76]. La riduzione media della pressione arteriosa con un'integrazione K + da 60 a 120 mmol / d è di 4.4 / 2.5 mmHg nei pazienti ipertesi, ma può arrivare fino a 8 / 4.1 mmHg con 120 mmol / d (4700 mg) [10,74,76,77 ]. Nei pazienti ipertesi, la relazione lineare dose-risposta è di 1.0 mmHg di riduzione della PAS e di 0.52 mmHg di pressione diastolica per aumento di 0.6 g / d dell'assunzione di potassio con la dieta che è indipendente dall'ingestione di potassio nella dieta basale [10]. La risposta dipende dalla razza (nero> bianco), dall'assunzione di sodio, magnesio e calcio [10]. Quelli con una maggiore assunzione di sodio hanno una maggiore riduzione della pressione arteriosa con il potassio [10]. L'alterazione del rapporto K + / Na + a un livello più alto è importante sia per gli effetti antipertensivi che per quelli cardiovascolari e cerebrovascolari [10,77]. Un'elevata assunzione di potassio riduce l'incidenza di malattie cardiovascolari (CHD, MI) e CVA indipendentemente dalla riduzione della pressione arteriosa [10,74,76,77]. Ci sono anche riduzioni di CHF, LVH, diabete mellito e aritmie cardiache [10]. Se il potassio sierico è inferiore a 4.0 meq / dL, vi è un aumento del rischio di mortalità per CVD, tachicardia ventricolare, fibrillazione ventricolare e CHF [10]. Il potassio dei globuli rossi è un'indicazione migliore delle riserve corporee totali e del rischio di CVD rispetto al potassio sierico [10]. Gu et al [77] hanno scoperto che la supplementazione di potassio a 60 mmol di KCl al giorno per 12 settimane riduceva significativamente la SBP -5.0 mmHg (intervallo da -2.13 a -7.88 mmHg) (p <0.001) in 150 uomini e donne cinesi di età compresa tra 35 e 64 anni anni.
Il potassio aumenta la natriuresi, modula la sensibilità baroriflessa, vasodilata, diminuisce la sensibilità alle catecolamine e all'angiotensina ?, aumenta l'ATPasi di sodio e potassio e la sintesi del DNA nelle cellule muscolari lisce vascolari e diminuisce l'attività del SNS nelle cellule con funzione vascolare migliorata[10]. Inoltre, il potassio aumenta la bradichinina e la callicreina urinaria, diminuisce la NADPH ossidasi, che riduce lo stress ossidativo e l'infiammazione, migliora la sensibilità all'insulina, diminuisce l'ADMA, riduce il sodio intracellulare e riduce la produzione di TGF-?[10].
Ogni aumento di 1000 mg di potassio al giorno riduce la mortalità per tutte le cause di circa il 20%. Si stima che l'assunzione di potassio di 4.7 g/die riduca il CVA dall'8% al 15% e l'IM del 6%-11%[10]. Numerosi SNP come la sottofamiglia del recettore nucleare 3 gruppo C, l'angiotensina ? recettore di tipo e l'idrossisteroide 11 beta deidrogenasi (HSD11B1 e B2) determinano la risposta di un individuo all'assunzione di potassio nella dieta[78]. Ogni 1000 mg di diminuzione dell'assunzione di sodio al giorno ridurrà la mortalità per tutte le cause del 20%[10,73]. Una recente analisi ha suggerito una risposta dose-correlata alla CVA con l'escrezione urinaria di potassio[79]. C'era una RRR di CVA del 23% a 1.5-1.99 g, 27% a 2.0-2.49 g, 29% a 2.5-3 g e 32% su 3 g/die di escrezione urinaria di potassio[79]. L'assunzione alimentare giornaliera raccomandata per i pazienti con ipertensione è di 4.7-5.0 g di potassio e meno di 1500 mg di sodio[10]. Il potassio negli alimenti o dagli integratori deve essere ridotto o usato con cautela in quei pazienti con insufficienza renale o in quelli che assumono farmaci che aumentano la ritenzione renale di potassio come ACEI, ARB, DRI e antagonisti del recettore dell'aldosterone sierico[10].
Magnesio
Un elevato apporto dietetico di magnesio di almeno 500-1000 mg / d riduce la PA nella maggior parte degli studi epidemiologici, osservazionali e clinici riportati, ma i risultati sono meno coerenti di quelli osservati con Na + e K + [74,80]. Nella maggior parte degli studi epidemiologici, esiste una relazione inversa tra l'assunzione di magnesio nella dieta e la BP [74,80,81]. Uno studio sui soggetti ipertensivi essenziali 60 trattati con integratori di magnesio ha mostrato una significativa riduzione della PA nell'arco di otto settimane, documentata da BP ambulatoriale 24, sangue del sangue di casa e ufficio [74,80,81]. La massima riduzione degli studi clinici è stata 5.6 / 2.8 mmHg ma alcuni studi non hanno mostrato alcun cambiamento nella BP [82]. La combinazione di un elevato apporto di potassio e di sodio con un maggiore apporto di magnesio ha avuto effetti antipertensivi aggiuntivi [82]. Il magnesio aumenta anche l'efficacia di tutti i farmaci anti-ipertensivi [82].
Il magnesio compete con il Na+ per i siti di legame sulla muscolatura liscia vascolare e agisce come vasodilatatore diretto, come un CCB. Il magnesio aumenta la prostaglandina E (PGE), regola il calcio intracellulare, sodio, potassio e pH, aumenta l'ossido nitrico, migliora la funzione endoteliale, riduce oxLDL, riduce HS-CRP, TBxA2, A-? e norepinefrina. Il magnesio migliora anche la resistenza all'insulina, il glucosio e la SM, si lega in maniera necessaria-cooperativa al potassio, inducendo riduzione di EDV e PA, riduce CVD e aritmie cardiache, diminuisce l'IMT carotideo, abbassa il colesterolo, abbassa la produzione di citochine, inibisce il fattore nucleare Kb, riduce l'ossidazione stress e inibisce l'aggregazione piastrinica per ridurre la trombosi[74,80-86].
Il magnesio è un co-fattore essenziale per l'enzima delta6-desaturasi che è il passo limitante per la conversione dell'acido linoleico (LA) in acido gamma linolenico (GLA) [74,80,81,83-85] necessario per la sintesi del vasodilatatore e inibitore piastrinico PGE1 . I canali alterati TRPM7, che sono il trasportatore per il magnesio, si verificano in molti pazienti ipertesi [83].
Una meta-analisi di pazienti 241378 con ictus 6477 ha mostrato una relazione inversa di magnesio dietetico all'incidenza di ictus ischemico [84]. Per ogni mg di 100 di assunzione di magnesio nella dieta, l'ictus ischemico è diminuito del 8%. Il meccanismo proposto include l'inibizione del rilascio di glutammato indotto da ischemia, il blocco del recettore NMDA, le azioni del CCB, il buffering del calcio mitocondriale, la diminuzione della deplezione dell'ATP e la vasodilatazione delle arterie cerebrali [84]. Una meta-analisi ha mostrato riduzioni della PA di 3-4 / 2-3 mmHg negli studi 22 di pazienti 1173 [87].
Il livello intracellulare di magnesio (RBC) è più indicativo delle riserve totali di corpo e deve essere misurato in combinazione con il siero e il magnesio urinario [83]. Il magnesio può essere integrato in dosi di 500 a 1000 mg / die. Le formulazioni di magnesio chelate a un amminoacido possono migliorare l'assorbimento e ridurre l'incidenza di diarrea [82]. L'aggiunta di taurina a 1000 a 2000 mg / d migliorerà gli effetti anti-ipertensivi del magnesio [82]. Gli integratori di magnesio devono essere evitati o utilizzati con cautela in pazienti con insufficienza renale nota o in quelli che assumono farmaci che inducono la ritenzione di magnesio [82].
Calcio
Gli studi sulla popolazione mostrano un legame tra ipertensione e calcio[88], ma studi clinici che hanno somministrato integratori di calcio ai pazienti hanno mostrato effetti incoerenti sulla PA[88]. Le risposte eterogenee alla supplementazione di calcio sono state spiegate da Resnick[89]. Questa è l'"ipotesi ionica"[89] dell'ipertensione, delle malattie cardiovascolari e dei disordini metabolici, funzionali e strutturali associati. L'integrazione di calcio non è raccomandata in questo momento come mezzo efficace per ridurre la pressione arteriosa.
Zinco
Bassi livelli sierici di zinco negli studi osservazionali sono correlati all'ipertensione e alla CHD, tipo ? DM, iperlipidemia, aumento della lipoproteina a [Lp(a)], aumento dei livelli di insulina plasmatica postprandiale 2 ore e resistenza all'insulina[90,91]. Lo zinco viene trasportato nel muscolo cardiaco e vascolare e in altri tessuti dalla metallotioneina[92]. Le carenze genetiche di metallotioneina con carenze intramuscolari di zinco possono portare ad un aumento dello stress ossidativo, disfunzione mitocondriale, disfunzione dei cardiomiociti e apoptosi con conseguente fibrosi miocardica, rimodellamento cardiaco anomalo, malattie cardiache, insufficienza cardiaca o ipertensione[92]. Il calcio intracellulare aumenta lo stress ossidativo che è ridotto dallo zinco[92]. Bergomi et al[93] hanno valutato lo stato dello Zinco (Zn++) in 60 soggetti ipertesi rispetto a 60 soggetti di controllo normotesi. È stata osservata una correlazione inversa tra PA e Zn++ sierico. La PA era anche inversamente correlata ad un'attività enzima-lisil ossidasi dipendente da Zn++. Lo Zn++ inibisce l'espressione genica e la trascrizione attraverso NF-?be la proteina-1 attivata ed è un importante cofattore per la SOD[90,92]. Questi effetti più quelli sulla resistenza all'insulina, lo scambio ionico di membrana, gli effetti RAAS e SNS possono spiegare gli effetti antipertensivi dello Zn++[90,92]. L'assunzione di zinco dovrebbe essere di 50 mg/die[1].
Proteine
Studi osservazionali ed epidemiologici dimostrano un'associazione coerente tra un'elevata assunzione di proteine e una riduzione della PA e della PA incidente[94,95]. La fonte proteica è un fattore importante nell'effetto BP; le proteine animali sono meno efficaci delle proteine non animali o vegetali, in particolare le mandorle[94-97]. Nello studio Inter-Salt su oltre 10000 soggetti, quelli con un apporto proteico alimentare del 30% superiore alla media avevano una pressione arteriosa inferiore di 3.0/2.5 mmHg rispetto a quelli che erano del 30% inferiori alla media (81 vs 44 g/giorno)[ 94]. Tuttavia, proteine animali magre o selvatiche con meno grassi saturi e acidi grassi omega-3 più essenziali possono ridurre la pressione arteriosa, i lipidi e il rischio di malattia coronarica[94,97]. Una meta-analisi ha confermato questi risultati e ha anche suggerito che i pazienti ipertesi e gli anziani hanno la maggiore riduzione della PA con l'assunzione di proteine[95]. Un'altra meta-analisi di 40 studi con 3277 pazienti ha riscontrato riduzioni della PA di 1.76/1.15 mmHg rispetto all'assunzione di carboidrati (p <0.001)[98]. Sia le proteine vegetali che quelle animali hanno ridotto significativamente e in egual modo la PA rispettivamente a 2.27/1.26 mmHg e 2.54/0.95 mmHg[98]. L'aumento dell'assunzione di proteine nella dieta è inversamente associato al rischio di ictus nelle donne ipertese[99]. Uno studio cross-over randomizzato su 352 adulti con pre-ipertensione e ipertensione allo stadio? ha riscontrato una significativa riduzione della pressione arteriosa sistolica di 2.0 mmHg con proteine della soia e 2.3 mmHg con proteine del latte rispetto a una dieta ad alto indice glicemico in ciascuno dei periodi di trattamento di 8 settimane [100]. C'è stata una riduzione non significativa del DBP. Un altro studio parallelo RDB su 4 settimane su 94 soggetti con preipertensione e ipertensione allo stadio iniziale ha riscontrato riduzioni significative della PA ambulatoriale di 4.9/2.7 mmHg in quelli a cui è stata data una combinazione di assunzione di proteine al 25% rispetto al gruppo di controllo a cui è stato somministrato il 15% di proteine in modo isocalorico[ 101]. La proteina era costituita dal 20% di piselli, 20% di soia, 30% di uova e 30% di proteine del latte isolate[101]. L'assunzione giornaliera raccomandata di proteine da tutte le fonti è compresa tra 1.0 e 1.5 g/kg di peso corporeo, che varia in base al livello di esercizio, all'età, alla funzione renale e ad altri fattori[1,70,71].
Il latte fermentato integrato con concentrato di proteine del siero di latte riduce significativamente la PA negli studi sull'uomo[102-106]. La somministrazione di 20 g/die di integratore di proteine del siero di latte idrolizzate ricco di peptidi bioattivi ha ridotto significativamente la PA in 6 settimane di 8.0 ÷ 3.2 mmHg nella PAS e 5.5 ÷ 2.1 mm nella PA diastolica[103]. I peptidi del latte che contengono sia caseine che proteine del siero di latte sono una ricca fonte di peptidi ACEI. Val-Pro-Pro e Ile-Pro-Pro somministrati da 5 a 60 mg/die hanno riduzioni variabili della PA con una diminuzione media negli studi aggregati di circa 1.28-4.8/0.59-2.2 mmHg[71,100,104-107]. Tuttavia, diverse meta-analisi recenti non hanno mostrato riduzioni significative della PA nell'uomo[106,108]. Il latte fermentato in polvere con Lactobacillus helveticus somministrato a 12 g/die ha ridotto significativamente la PA di 11.2/6.5 mmHg in 4 settimane in uno studio[104]. I peptidi del latte sono utili nel trattamento della SM[109]. Uno studio dose-risposta ha mostrato riduzioni insignificanti della PA[110]. La risposta clinica è attribuita ai peptidi attivi del latte fermentato che inibiscono l'ACE.
Pins et al [111] hanno somministrato 20 g di proteina di siero di latte idrolizzato a soggetti ipertensivi di 56 e hanno notato una riduzione della PA di 11 / 7 mmHg rispetto ai controlli a una settimana sostenuti durante lo studio. Le proteine del siero del latte sono efficaci nel migliorare i lipidi, l'insulino-resistenza, il glucosio, la rigidità arteriosa e la PA [112]. Questi dati indicano che la proteina del siero di latte deve essere idrolizzata allo scopo di mostrare un effetto antipertensivo e la risposta massima alla PA è dose-dipendente.
I peptidi derivati dalla caseina bovina e i peptidi derivati da proteine del siero del latte mostrano attività ACEI [102-111]. Questi componenti includono B-caseine, frazioni B-lg, B2-microglobulina e albumina sierica [102-104,111]. L'idrolisi enzimatica degli isolati proteici di siero di latte rilascia peptidi ACEI.
I peptidi di collagene marino (MCP) dei pesci di profondità hanno attività anti-ipertensiva [113-115]. In uno studio in doppio cieco controllato con placebo in soggetti ipertensivi 100 con diabete che hanno ricevuto MCP due volte al giorno per 3 mo si sono osservate riduzioni significative del DBP e della pressione arteriosa media [113]. La proteina di Bonito (Sarda Orientalis), della famiglia di tonno e sgombro, ha peptidi inibitori naturali ACEI e riduce BP 10.2 / 7 mmHg a 1.5 g / d [114,116].
La proteina muscolare della sardina, che contiene Valil-Tirosina (VAL-TYR), riduce significativamente la PA nei soggetti ipertesi[117]. Kawasaki et al[117] hanno trattato 29 soggetti ipertesi con 3 mg di estratto concentrato di muscolo di sardina VAL-TYR per quattro settimane e abbassato la PA di 9.7/5.3 mmHg (p <0.05). Livelli di A-?aumentati come siero A-? e l'aldosterone è diminuito indicando che VAL-TYR è un ACEI naturale. Uno studio simile con una bevanda vegetale con idrolizzati proteici di sardina ha ridotto significativamente la PA di 8/5 mmHg in 13 settimane[118].
La proteina di soia abbassa la PA nei pazienti ipertesi nella maggior parte degli studi [100,119-127]. L'assunzione di proteine di soia è risultata significativamente e inversamente associata sia a SBP che a DBP nelle donne cinesi 45694 che assumevano 25 g / die o più di proteina di soia negli anni 3 e l'associazione è aumentata con l'età [119]. La riduzione SBP è stata 1.9 a 4.9 mm inferiore e DBP 0.9 a 2.2 mmHg inferiore [119]. Tuttavia, studi clinici randomizzati e meta-analisi hanno mostrato risultati misti su BP senza variazioni della pressione arteriosa a riduzioni di 7% a 10% per SBP e DBP [121-125]. La recente meta-analisi degli studi 27 ha riscontrato una significativa riduzione della PA di 2.21 / 1.44 mmHg [120]. Alcuni studi suggeriscono un miglioramento della funzione endoteliale, una migliore compliance arteriosa, riduzione della HS-CRP e dell'infiammazione, attività dell'ACEI, riduzione del tono simpatico, azione diuretica e riduzione sia dello stress ossidativo che dei livelli di aldosterone [125-127]. Si consiglia la soia fermentata a circa 25 g / d.
Oltre agli effetti ACEI, l'assunzione di proteine può anche alterare le risposte alle catecolamine e indurre un effetto natriuretico [117,118]. Assunzione di proteine povere accoppiato con basso consumo di acido grasso 3 può contribuire all'ipertensione nei modelli animali [128]. L'apporto proteico ottimale, in base al livello di attività, alla funzione renale, allo stress e ad altri fattori, si riferisce a 1.0 a 1.5 g / kg al giorno [1].
Aminoacidi e composti correlati
L-arginina: L-arginina e metilarginine endogene sono i precursori primari per la produzione di NO, che ha numerosi effetti benefici cardiovascolari, mediati dalla conversione di L-arginina a NO da eNOS. Pazienti con ipertensione, iperlipidemia, diabete mellito e aterosclerosi hanno aumentato i livelli di HSCRP e infiammazione, aumento della microalbumina, bassi livelli di apelina (stimola NO nell'endotelio), aumento dei livelli di arginasi (abbatte l'arginina) ed elevati livelli sierici di ADMA, che inattiva NO [129-133].
In condizioni fisiologiche normali, i livelli di arginina intracellulare superano di gran lunga il Km [costante di Michaelis Menton (MMC)] di eNOS che è inferiore a 5 µmol[134]. Tuttavia, la formazione di NO endogeno dipende dalla concentrazione di arginina extracellulare[134]. Le concentrazioni intracellulari di L-arginina sono 0.1-3.8 mmol/L nelle cellule endoteliali mentre la concentrazione plasmatica di arginina è 80-120 µmol/L che è circa 20-25 volte maggiore della MMC[135,136]. Nonostante ciò, la formazione di NO cellulare dipende dalla L-arginina esogena e questo è il paradosso dell'arginina. L'arginina renale regola la pressione arteriosa e blocca la formazione di endotelina, riduce il riassorbimento renale di sodio ed è un potente antiossidante[134]. La produzione di NO nelle cellule endoteliali è strettamente associata all'assorbimento cellulare dell'arginina, indicando che i meccanismi di trasporto dell'arginina giocano un ruolo importante nella regolazione della funzione NO-dipendente. L'arginina esogena può aumentare la biodisponibilità di NO vascolare e tubulare renale e influenzare la perfusione renale, la funzione e la pressione arteriosa[132]. Il disaccoppiamento molecolare di eNOS può verificarsi in assenza di tetraidrobiopterina che stabilizza eNOS, che porta alla produzione di ROS[135].
Studi sull'uomo in soggetti ipertesi e normotesi di somministrazione parenterale e orale di L-arginina dimostrano un effetto antipertensivo nonché un miglioramento del flusso sanguigno coronarico e del flusso sanguigno periferico nella PAD[129,136-140]. La PA è diminuita di 6.2/6.8 mmHg con 10 g/die di L-arginina quando somministrato come integratore o attraverso alimenti naturali a un gruppo di soggetti ipertesi[136]. L'arginina produce una diminuzione statisticamente e biologicamente significativa della pressione arteriosa e un miglioramento dell'effetto metabolico negli esseri umani normotesi e ipertesi di entità simile a quella osservata nella dieta DASH?[136]. L'arginina somministrata a 4 g/die ha anche ridotto significativamente la pressione arteriosa nelle donne con ipertensione gestazionale senza proteinuria, ha ridotto la necessità di terapia antipertensiva, ha ridotto le complicanze materne e neonatali e ha prolungato la gravidanza[137,138]. La combinazione di arginina (1200 mg/die) e N-acetil cisteina (NAC) (600 mg bid) somministrata nell'arco di 6 mesi a pazienti ipertesi con diabete di tipo 2, diminuzione della pressione arteriosa e pressione sanguigna (p < 0.05), aumento del colesterolo HDL, diminuzione di LDL-C e oxLDL, riduzione di HSCRP, ICAM, VCAM, PAI-?, fibrinogeno e IMT[139]. Uno studio su 54 soggetti ipertesi trattati con arginina 4 g tre volte al giorno per quattro settimane ha avuto riduzioni significative dell'ABM nelle 24 ore[140]. Una meta-analisi di 11 studi con 383 soggetti a cui è stata somministrata arginina 4-24 g/die ha riscontrato una riduzione media della pressione arteriosa di 5.39/2.66 mmHg (p < 0.001) in 4 settimane[141]. Sebbene queste dosi di L-arginina sembrino essere sicure, al momento non sono stati pubblicati studi a lungo termine sull'uomo e si teme un effetto pro-ossidativo o addirittura un aumento della mortalità in pazienti che possono avere endotelio gravemente disfunzionale, avanzato aterosclerosi, CHD, ACS o MI[142]. Oltre al percorso arginina-NO, esiste un percorso nitrato/nitrito che è correlato ai nitrati alimentari da verdure, succo di barbabietola e dalla dieta DASH che vengono convertiti in nitriti da batteri simbiotici, salivari, gastrointestinali e orali[143]. La somministrazione di succo o estratto di barbabietola a 500 mg/die aumenterà i nitriti e abbasserà la pressione arteriosa, migliorerà la funzione endoteliale, aumenterà il flusso sanguigno cerebrale, coronarico e periferico[143].
L-carnitina e acetil-L-carnitina: La L-carnitina è un costituente azotato del muscolo coinvolto principalmente nell'ossidazione degli acidi grassi nei mammiferi. Gli studi sugli animali indicano che la carnitina ha sia effetti anti-ipertensivi sistemici che effetti antiossidanti nel cuore mediante sovraregolazione di eNOS e PPAR gamma, inibizione di RAAS, modulazione di NF-?B e sottoregolazione di NOX2, NOX4, TGF- ? e CTGF che riduce la fibrosi cardiaca[144,145]. La funzione endoteliale, l'NO e la difesa ossidativa sono migliorate mentre lo stress ossidativo e la PA sono ridotti[144-147]. Gli studi sull'uomo sugli effetti della L-carnitina e dell'acetil-L-carnitina sono limitati, con variazioni minime o nulle della PA[148-153]. Nei pazienti con SM, l'acetil-L-carnitina a un grammo bid in 8 settimane, ha migliorato la disglicemia e ridotto la pressione arteriosa sistolica di 7-9 mmHg, ma la pressione diastolica era significativamente ridotta solo in quelli con glicemia più alta[151]. Bassi livelli di carnitina sono associati a un pattern PA non dipping nel DM di tipo 2[153]. La carnitina ha effetti antiossidanti e antinfiammatori e può essere utile nel trattamento dell'ipertensione essenziale, tipo ? DM con ipertensione, iperlipidemia, aritmie cardiache, CHF e sindromi ischemiche cardiache[1,149,150,153]. Si consigliano dosi di 2-3 g due volte al giorno.
Taurina: La taurina è un beta-amminoacido solfonico che è considerato un amminoacido condizionatamente essenziale, che non è utilizzato nella sintesi proteica, ma si trova libero o in semplici peptidi con la sua più alta concentrazione nel cervello, nella retina e nel miocardio [154]. Nei cardiomiociti, rappresenta circa il 50% degli aminoacidi liberi e ha un ruolo di osmoregolatore, fattore inotropico e agente antipertensivo [155].
Studi sull'uomo hanno notato che i soggetti ipertesi essenziali hanno ridotto la taurina urinaria così come altri aminoacidi solforati[1,154,155]. La taurina abbassa la PA, SVR e FC, diminuisce le aritmie, i sintomi di CHF e l'attività del SNS, aumenta l'escrezione urinaria di sodio e acqua, aumenta il fattore natriuretico atriale, migliora la resistenza all'insulina, aumenta l'NO e migliora la funzione endoteliale. La taurina riduce anche A-?, PRA, aldosterone, attività SNS, noradrenalina plasmatica, adrenalina plasmatica e urinaria, abbassa l'omocisteina, migliora la sensibilità all'insulina, la reattività delle chinine e dell'acetilcolina, diminuisce il calcio e il sodio intracellulari, riduce la risposta ai recettori beta e ha proprietà antiossidanti, attività antiaterosclerotiche e antinfiammatorie, riduce l'IMT e la rigidità arteriosa e può proteggere dal rischio di malattia coronarica[1,154-160]. Una taurina urinaria inferiore è associata ad un aumento del rischio di ipertensione e malattie cardiovascolari[160,161]. Uno studio su 31 maschi giapponesi con ipertensione essenziale sottoposti a un programma di esercizi per 10 settimane ha mostrato un aumento del 26% dei livelli di taurina e un aumento del 287% dei livelli di cisteina. La riduzione della PA di 14.8/6.6 mmHg era proporzionale all'aumento della taurina sierica e alla riduzione della noradrenalina plasmatica[162]. Fujita et al[155] hanno dimostrato una riduzione della PA di 9/4.1 mmHg (p < 0.05) in 19 soggetti ipertesi trattati con 6 g di taurina per 7 giorni. La taurina ha numerosi effetti benefici sul sistema cardiovascolare e sulla pressione arteriosa[156]. La dose raccomandata di taurina è di 2-3 g/die alla quale non si notano effetti avversi, ma potrebbero essere necessarie dosi più elevate fino a 6 g/die per ridurre significativamente la PA[1,70,71,154-162].
Grassi Omega-3
Gli acidi grassi omega-3 si trovano in pesci di acqua fredda, oli di pesce, lino, semi di lino, olio di lino e noci in BP inferiore in studi clinici osservazionali, epidemiologici e prospettici [163-173]. I risultati sono rafforzati da una risposta dose-correlata nell'ipertensione e da una relazione con le malattie concomitanti specifiche associate all'ipertensione [163-173].
Gli studi indicano che il DHA a 2 g/die riduce la pressione arteriosa e la frequenza cardiaca[163,173]. La riduzione media della pressione arteriosa è di 8/5 mmHg e la frequenza cardiaca scende di circa 6 battiti/min di solito in circa 6 settimane[1,70,71,91-175]. Anche l'olio di pesce a 4-9 g/die o una combinazione di DHA ed EPA a 3-5 g/die ridurrà la BP[1,168-173]. Tuttavia, la formazione di EPA e infine di DHA da ALA è ridotta in presenza di alti livelli di LA (l'acido grasso essenziale omega-6), grassi saturi, acidi grassi trans, alcol, diverse carenze di nutrienti (magnesio, vitamina B6) e invecchiamento, tutti di cui inibiscono gli enzimi desaturasi[163]. Mangiare pesce d'acqua fredda tre volte alla settimana può essere efficace quanto l'olio di pesce ad alte dosi nel ridurre la pressione arteriosa nei pazienti ipertesi, e le proteine del pesce possono anche avere effetti antipertensivi[1,163]. Nei pazienti con malattia renale cronica 4 g di acidi grassi omega 3 hanno ridotto la pressione arteriosa misurata con 24 h ABM in 8 settimane di 3.3/2.9 mmHg rispetto al placebo (p < 0.0001)[167].
Il rapporto ideale tra omega-6 FA e omega-3 FA è compreso tra 1: 1 e 1: 4 con un rapporto tra grassi polinsaturi e saturi superiore a 1.5 a 2: 0 [2]. Gli acidi grassi Omega 3 aumentano l'eNOS e l'ossido nitrico, migliorano la funzione endoteliale, migliorano la sensibilità all'insulina, riducono l'afflusso di calcio, sopprimono l'attività dell'ACE e migliorano il tono parasimpatico [1,163-171]. La famiglia di omega-6 FA comprende LA, GLA, dihomo-GLA e AA che di solito non abbassano significativamente la PA, ma possono prevenire aumenti della PA indotta da grassi saturi [176]. GLA può bloccare l'ipertensione indotta da stress aumentando PGE1 e PGI2, riducendo i livelli di aldosterone, riducendo la densità e l'affinità di AT1R surrenale [175].
L'omega-3 FA ha una moltitudine di altre conseguenze cardiovascolari che modula la PA come aumenti di eNOS e ossido nitrico, miglioramento dell'ED, riduzione del plasma non-epinefrina e aumento del tono paraSNS, soppressione dell'attività dell'ACE e miglioramento dell'insulino-resistenza [ 176]. La dose giornaliera raccomandata è 3000 a 5000 mg / die di DHA ed EPA combinati in un rapporto di 3 parti EPA in 2 parti DHA e circa 50% di questa dose come GLA in combinazione con gamma / delta tocoferolo a 100 mg per grammo di DHA e EPA per ottenere l'indice 3 omega a 8% o superiore per ridurre BP e fornire una cardioprotezione ottimale [177]. Il DHA è più efficace dell'EPA per ridurre la PA e deve essere somministrato a 2 g / d se somministrato da solo [163,173].
Grassi Omega-9
L'olio d'oliva è ricco di acido oleico grasso monoinsaturo omega-9 (MUFA), che è stato associato alla pressione arteriosa e alla riduzione dei lipidi nelle diete mediterranee e in altre[178-180]. L'olio d'oliva e i MUFA hanno mostrato riduzioni consistenti della PA nella maggior parte degli studi clinici sull'uomo[178-190]. In uno studio, la PAS è diminuita di 8 mmHg (p ? 0.05) e la PAS è diminuita di 6 mmHg (p ? 0.01) sia nel monitoraggio della PA ambulatoriale che ambulatoriale 24 ore nei soggetti trattati con MUFA rispetto ai soggetti trattati con PUFA[178]. Inoltre, la necessità di farmaci antipertensivi è stata ridotta del 48% nel gruppo MUFA rispetto al 4% nel gruppo PUFA omega-6 (p <0.005). L'olio extra vergine di oliva (EVOO) è stato più efficace dell'olio di girasole nel ridurre la SBP in un gruppo di 31 pazienti ipertesi anziani in uno studio crossover randomizzato in doppio cieco[187]. La SBP era 136 mmHg nei soggetti trattati con EVOO vs 150 mmHg nel gruppo trattato con girasole (p <0.01). L'olio d'oliva riduce anche la pressione arteriosa nei soggetti diabetici ipertesi[188]. È l'alto contenuto di acido oleico nell'olio d'oliva che riduce la PA[180]. Nei pazienti in stadio ipertensivo, l'estratto di oleuropeina-foglia di olivo (Olea Eurpoaea) 500 mg bid per 8 settimane ha ridotto la pressione arteriosa di 11.5/4.8 mmHg, che era simile al captopril 25 mg bid[189]. L'estratto acquoso di Olea Eupopea L somministrato a 12 pazienti con ipertensione a 400 mg qid per 3 mesi ha ridotto significativamente la PA (p < 0.001)[181]. L'assunzione di olio d'oliva nello studio EPIC su 20343 soggetti era inversamente associata alla pressione sistolica e diastolica[182]. Nello studio SUN su 6863 soggetti, la PA era inversamente associata al consumo di olio d'oliva, ma solo negli uomini[183]. In uno studio su 40 gemelli monozigoti ipertesi, l'estratto di foglie di olivo ha dimostrato una riduzione dose-risposta della PA a dosi da 500 a 1000 mg/die in 8 settimane rispetto al placebo[184]. I gruppi a basso dosaggio hanno ridotto la PA di 3/1 mmHg e quelli ad alto dosaggio di 11/4 mmHg[184]. Uno studio di intervento dietetico crossover in doppio cieco, randomizzato, su 4 mesi utilizzando olio d'oliva ricco di polifenoli 30 mg/die ha ridotto la pressione arteriosa nel gruppo di studio di 7.91/6.65 mmHg e ha migliorato la funzione endoteliale[185]. I livelli di ADMA, oxLDL e HS-CRP sono stati ridotti nel gruppo dell'olio d'oliva. Nitriti e nitrati plasmatici sono aumentati e l'area iperemica dopo l'ischemia è migliorata nel gruppo trattato. L'olio d'oliva inibisce il recettore AT1R, esercita effetti calcio-antagonisti di tipo L e migliora i riflessi delle onde e l'indice di aumento[191-193].
EVOO contiene anche fitonutrienti liposolubili come i polifenoli. Circa 5 mg di fenoli si trovano in 10 g di EVOO [178,186]. A proposito di 4 cucchiai di EVOO è uguale a 40 g di EVOO, che è la quantità richiesta per ottenere riduzioni significative in BP.
Fibra
Le prove cliniche con vari tipi di fibre per ridurre la PA sono state incoerenti [194,195]. Fibra solubile, gomma guar, guava, psillio e crusca d'avena possono ridurre la PA e ridurre la necessità di farmaci antipertensivi in soggetti ipertesi, diabetici e soggetti ipertesi-diabetici [1,70,71,194,195]. La riduzione media di BP è di circa 7.5 / 5.5 mmHg su 40 a 50 g / d di una fibra mista. Vi è un miglioramento della sensibilità all'insulina, della funzione endoteliale, della riduzione dell'attività SNS e dell'aumento della perdita renale di sodio [1,70,71,194].
Vitamina C
La vitamina C è un potente donatore di elettroni solubile in acqua. A livelli fisiologici è un antiossidante anche se a dosi sovrafisiologiche come quelle ottenute con la vitamina C per via endovenosa dona elettroni a diversi enzimi che si traduce in effetti pro-ossidativi. A dosi fisiologiche la vitamina C ricicla la vitamina E, migliora l'ED e produce una diuresi [196]. L'assunzione di vitamina C e la concentrazione di ascorbato plasmatico nell'uomo sono inversamente correlate a SBP, DBP e frequenza cardiaca [196-210].
Una valutazione di studi clinici pubblicati indica che il dosaggio di vitamina C a 250 mg due volte al giorno ridurrà significativamente la pressione arteriosa sistolica di 5-7 mmHg e la pressione diastolica di 2-4 mmHg in 8 settimane[196-210]. La vitamina C indurrà una diuresi sodica, migliorerà la compliance arteriosa, migliorerà la funzione endoteliale, aumenterà l'ossido nitrico e la PGI2, diminuirà la produzione di steroidi surrenali, migliorerà l'equilibrio simpaticovagale, aumenterà l'ATPasi RBC Na/K, aumenterà la SOD, migliorerà l'elasticità e la compliance aortica, migliorerà il flusso vasodilatazione mediata, diminuzione della velocità dell'onda del polso e dell'indice di aumento, aumento del GMP ciclico, attivazione dei canali del potassio, riduzione del calcio citosolico e riduzione delle aldeidi sieriche[208]. La vitamina C previene la disfunzione erettile indotta da un carico di glucosio orale. La vitamina C aumenta l'efficacia dell'amlodipina, diminuisce l'affinità di legame del recettore AT 1 per l'angiotensina ? interrompendo i ponti disolfuro di ATR1 e potenziando gli effetti antipertensivi dei farmaci negli anziani con ipertensione refrattaria[1,70,71,200-205]. Nei pazienti anziani con ipertensione refrattaria già in terapia farmacologica massima, 600 mg di vitamina C al giorno hanno abbassato la pressione arteriosa di 20/16 mmHg[205]. Più basso è il livello sierico iniziale di ascorbato, migliore è la risposta pressoria. Si raccomanda un livello sierico di 100 µmol/L[1,70,71]. SBP e 24 ABM mostrano le riduzioni più significative con la somministrazione orale cronica di vitamina C[200-205]. Block et al[206] in un elegante studio sulla deplezione-replezione della vitamina C hanno dimostrato una correlazione inversa tra i livelli plasmatici di ascorbato, SBP e DBP. In una meta-analisi di tredici studi clinici con 284 pazienti, la vitamina C a 500 mg/die in 6 settimane ha ridotto la SBP di 3.9 mmHg e la DBP di 2.1 mmHg[207]. È stato riscontrato che i soggetti ipertesi hanno livelli di ascorbato plasmatico significativamente più bassi rispetto ai soggetti normotesi (rispettivamente 40 µmol/L vs 57 µmol/L)[211] e l'ascorbato plasmatico è inversamente correlato con la pressione arteriosa anche in individui sani e normotesi[206] .
Vitamina E
La maggior parte degli studi non ha mostrato riduzioni della PA con la maggior parte delle forme di tocoferoli o tocotrienoli [1,70,71]. Ai pazienti con T2DM e ipertensione controllata (130/76 mmHg) su prescrizione di farmaci con una pressione arteriosa media di 136/76 mmHg sono stati somministrati tocoferoli misti contenenti il 60% gamma, il 25% delta e il 15% alfa tocoferoli [212]. La pressione arteriosa effettivamente è aumentata di 6.8 / 3.6 mmHg nei pazienti dello studio (p <0.0001) ma è stata inferiore rispetto all'aumento con alfa tocoferolo di 7 / 5.3 mmHg (p <0.0001). Questo può essere un riflesso delle interazioni farmacologiche con i tocoferoli tramite il citocromo P 450 (3A4 e 4F2) e della riduzione dei livelli sierici dei trattamenti farmacologici che venivano somministrati contemporaneamente [212]. Il gamma-tocoferolo può avere effetti natriuretici mediante l'inibizione del canale del potassio 70pS nel grosso arto ascendente dell'ansa di Henle e della PA inferiore [213]. Sia l'alfa che il gamma tocoferolo migliorano la sensibilità all'insulina e aumentano l'espressione dell'adiponectina attraverso processi PPAR gamma dipendenti, che hanno il potenziale per abbassare la pressione arteriosa e il glucosio sierico [214]. Se la vitamina E ha un effetto antipertensivo, è probabilmente piccolo e può essere limitato a pazienti ipertesi non trattati oa quelli con malattie vascolari note o altri problemi concomitanti come il diabete o l'iperlipidemia.
Vitamina D
La vitamina D3 può avere un ruolo indipendente e diretto nella regolazione della pressione arteriosa e del metabolismo dell'insulina[215-225]. La vitamina D influenza la pressione sanguigna per i suoi effetti sul metabolismo calcio-fosfato, sul sistema RAA, sul sistema immunitario, sul controllo delle ghiandole endocrine e sulla disfunzione erettile[216]. Se il livello di vitamina D è inferiore a 30 ng/ml, i livelli di PRA circolante sono più elevati, il che aumenta l'angiotensina ?, aumenta la pressione arteriosa e riduce il flusso sanguigno renale plasmatico[221]. Più basso è il livello di vitamina D, maggiore è il rischio di ipertensione, con il quartile più basso di vitamina D sierica con un'incidenza di ipertensione del 52% e il quartile più alto con un'incidenza del 20%[221]. La vitamina D3 sopprime marcatamente la trascrizione della renina mediante un meccanismo mediato da VDR tramite l'apparato JGA. Il suo ruolo negli elettroliti, nel volume e nell'omeostasi della pressione arteriosa indica che la vitamina D3 è importante nel miglioramento dell'ipertensione. La vitamina D abbassa l'ADMA, sopprime le citochine pro-infiammatorie come il TNF-?, aumenta l'ossido nitrico, migliora la funzione endoteliale e l'elasticità arteriosa, diminuisce l'ipertrofia della muscolatura liscia vascolare, regola gli elettroliti e il volume del sangue, aumenta la sensibilità all'insulina, riduce la concentrazione di acidi grassi liberi, regola l'espressione del recettore del peptide natriuretico e abbassa l'HS-CRP[217-219,221].
L'effetto ipotensivo della vitamina D era inversamente correlato ai livelli sierici pretrattamento di 1,25 (OH) 2D3 e additivo ai farmaci antipertensivi. Pfeifer et al [225] hanno dimostrato che l'integrazione a breve termine con vitamina D3 e calcio è più efficace nel ridurre la SBP rispetto al solo calcio. In un gruppo di 148 donne con bassi livelli di 25 (OH) 2D3, la somministrazione di 1200 mg di calcio più 800 UI di vitamina D3 ha ridotto la SBP del 9.3% in più (p <0.02) rispetto a 1200 mg di calcio da solo. L'HR è sceso del 5.4% (p = 0.02), ma il DBP non è stato modificato. L'intervallo nella riduzione della PA era compreso tra 3.6 / 3.1 e 13.1 / 7.2 mmHg. La riduzione della pressione arteriosa è correlata al livello pretrattamento di vitamina D3, alla dose di vitamina D3 e al livello sierico di vitamina D3, ma la pressione arteriosa è ridotta solo nei pazienti ipertesi. Sebbene la carenza di vitamina D sia associata all'ipertensione negli studi osservazionali, studi clinici randomizzati e la loro meta-analisi hanno prodotto risultati inconcludenti [223]. Inoltre, i polimorfismi del gene del recettore della vitamina D possono influenzare il rischio di ipertensione negli uomini [224]. Si raccomanda un livello di 25 idrossivitamina D di 60 ng / ml.
Vitamina B6 (piridossina)
Bassi livelli sierici di vitamina B6 (piridossina) sono associati all'ipertensione nell'uomo[226]. Uno studio sull'uomo di Aybak et al[227] ha dimostrato che alte dosi di vitamina B6 a 5 mg/kg al giorno per 4 settimane hanno abbassato significativamente la PA di 14/10 mmHg. La piridossina (vitamina B6) è un cofattore nel neurotrasmettitore e nella sintesi ormonale nel sistema nervoso centrale (norepinefrina, epinefrina, serotonina, GABA e chinurenina), aumenta la sintesi della cisteina per neutralizzare le aldeidi, aumenta la produzione di glutatione, blocca i canali del calcio, migliora la resistenza all'insulina , diminuisce il tono simpatico centrale e riduce la reattività dell'organo terminale ai glucocorticoidi e ai mineralcorticoidi[1,70,71,228,229]. La vitamina B6 è ridotta con la terapia diuretica cronica e l'eme pirolattamico. La vitamina B6 ha quindi un'azione simile agli alfa agonisti centrali, ai diuretici e ai CCB. La dose raccomandata è di 200 mg/die per via orale.
I flavonoidi
Oltre 4000 flavonoidi presenti in natura sono stati identificati in sostanze così diverse come frutta, verdura, vino rosso, tè, soia e liquirizia[230]. I flavonoidi (flavonoli, flavoni e isoflavoni) sono potenti scavenger di radicali liberi che inibiscono la perossidazione lipidica, prevengono l'aterosclerosi, promuovono il rilassamento vascolare e hanno proprietà antipertensive[230]. Inoltre, riducono l'ictus e forniscono effetti cardioprotettivi che riducono la morbilità e la mortalità coronarica[231].
Il resveratrolo è un potente antiossidante e antipertensivo presente nella buccia dell'uva rossa e nel vino rosso. La somministrazione di resveratrolo all'uomo riduce l'indice di aumento, migliora la compliance arteriosa e abbassa la pressione arteriosa centrale quando somministrato come 250 ml di vino rosso normale o dealcolato[232]. C'è stata una riduzione significativa dell'indice di aumento dell'aorta del 6.1% con il vino rosso dealcolato e del 10.5% con il vino rosso normale. La pressione arteriosa centrale è stata significativamente ridotta dal vino rosso dealcolato a 7.4 mmHg e 5.4 mmHg dal vino rosso normale. Il resveratrolo aumenta la vasodilatazione mediata dal flusso in modo dose correlato, migliora la disfunzione erettile, previene il disaccoppiamento di eNOS, aumenta l'adiponectina, riduce l'HS-CRP e blocca gli effetti dell'angiotensina ?[233-236]. La dose raccomandata è 250 mg/die di trans resveratrolo[234].
Licopene
Il licopene è un fitonutriente liposolubile della famiglia dei carotenoidi. Le fonti alimentari includono pomodori, guaiava, pompelmo rosa, anguria, albicocche e papaia in alte concentrazioni[237-241]. Il licopene produce una significativa riduzione della pressione arteriosa, dei lipidi sierici e dei marker di stress ossidativo[237-241]. Paran et al[241] hanno valutato 30 soggetti con ipertensione di grado?, età 40-65, che non assumevano farmaci antipertensivi o anti-lipidi trattati con un estratto di licopene di pomodoro (10 mg di licopene) per otto settimane. La PAS è stata ridotta da 144 a 135 mmHg (riduzione di 9 mmHg, p < 0.01) e la pressione sanguigna è scesa da 91 a 84 mmHg (riduzione di 7 mmHg, p < 0.01). Un altro studio su 35 soggetti con ipertensione di grado? ha mostrato risultati simili su SBP, ma non su DBP[237]. Englehard ha somministrato un estratto di pomodoro a 31 soggetti ipertesi nell'arco di 12 settimane, dimostrando una significativa riduzione della PA di 10/4 mmHg[238]. I pazienti in trattamento con vari agenti antipertensivi tra cui ACEI, CCB e diuretici hanno avuto una significativa riduzione della PA di 5.4/3 mmHg in 6 settimane quando è stato somministrato un estratto di pomodoro standardizzato[239]. Altri studi non hanno mostrato cambiamenti della PA con il licopene[240]. Il licopene e l'estratto di pomodoro migliorano la disfunzione erettile e riducono lo stress ossidativo totale plasmatico[242]. L'assunzione giornaliera raccomandata di licopene è di 10-20 mg sotto forma di cibo o integratore.
Pycnogenol
Pycnogenol, un estratto di corteccia del pino marittimo francese, a dosi di 200 mg / die ha determinato una significativa riduzione della SBP da 139.9 mmHg a 132.7 mmHg (p <0.05) in undici pazienti con ipertensione lieve per otto settimane in doppio cieco studio crossover randomizzato con placebo. La pressione diastolica è scesa da 93.8 mmHg a 92.0 mmHg. Il picnogenolo agisce come un ACEI naturale, protegge le membrane cellulari dallo stress ossidativo, aumenta l'NO e migliora la funzione endoteliale, riduce le concentrazioni sieriche di trombossano, diminuisce l'attività della mielo-perossidasi, migliora il flusso sanguigno corticale renale, riduce l'escrezione urinaria di albumina e diminuisce l'HS-CRP [243- 247]. Altri studi hanno mostrato riduzioni della pressione arteriosa e una ridotta necessità di ACEI e CCB, riduzioni di endotelina-1, HgA1C, glucosio a digiuno, LDL-C e mieloperossidasi [244,245,247].
aglio
Gli studi clinici che utilizzano la dose corretta, il tipo di aglio e preparazioni a lunga durata d'azione ben assorbite hanno mostrato riduzioni consistenti della PA nei pazienti ipertesi con una riduzione media della PA di 8.4/7.3 mmHg[248,249]. Non tutte le preparazioni a base di aglio vengono lavorate allo stesso modo e non sono comparabili nella potenza antipertensiva[1]. Inoltre, l'aglio coltivato (allium sativum), l'aglio selvatico incolto o l'aglio orsino (allium urisinum) e gli effetti delle preparazioni a base di aglio stagionato, fresco ea lunga azione differiscono[1,70,71,248,249]. L'aglio è anche efficace nel ridurre la pressione arteriosa nei pazienti con ipertensione non controllata già in trattamento con farmaci antipertensivi[249,250]. Un integratore a base di omogenato di aglio è stato somministrato a 34 pazienti preipertensivi e in stadio di ipertensione a 300 mg/die in 12 settimane con una riduzione della pressione arteriosa di 6.6-7.5/4.6-5.2 mmHg[249]. L'aglio invecchiato a dosi da 240 a 960 mg/die somministrate a 79 soggetti ipertesi per più di 12 settimane ha ridotto significativamente la SBP 11.8-5.4 mmHg nel gruppo dell'aglio ad alte dosi[249]. Un aglio rilasciato nel tempo può ridurre la pressione sanguigna meglio dell'aglio ad azione più breve[249]. Una revisione del database Cochrane ha indicato una riduzione netta della PA di 10-12/6-9 mmHg in tutti gli studi clinici con aglio[249]. In uno studio in doppio cieco parallelo randomizzato e controllato con placebo di 50 pazienti, 900 mg di estratto di aglio invecchiato con 2.4 mg di S-allilcisteina sono stati somministrati giornalmente per 12 settimane e hanno ridotto la pressione sanguigna di 10.2 mmHg (p = 0.03) in più rispetto al gruppo di controllo[ 250].
Circa 10000 mcg di allicina (uno degli ingredienti attivi nell'aglio) al giorno, la quantità contenuta in quattro spicchi d'aglio (5 g) è necessaria per ottenere un significativo effetto di riduzione della PA [1,70,71,249,250]. L'aglio ha attività ACEI, attività di blocco dei canali del calcio, riduce la sensibilità alla catecolamina, migliora la compliance arteriosa, aumenta la bradichinina e l'ossido nitrico e contiene adenosina, magnesio, flavonoidi, zolfo, allicina, fosforo e ajoeni che riducono la PA [1,70,71].
Alga marina
L'alga Wakame (Undaria pinnatifida) è l'alga commestibile più popolare in Giappone[251]. Nell'uomo, 3.3 g di Wakame essiccato per quattro settimane hanno ridotto significativamente sia la SBP 14 ÷ 3 mmHg che la DBP 5 ÷ 2 mmHg (p < 0.01)[252]. In uno studio su 62 soggetti di sesso maschile di mezza età con lieve ipertensione a cui era stata somministrata una preparazione di alghe cariche di potassio, a scambio ionico, adsorbente il sodio e a rilascio di potassio, si sono verificate riduzioni significative della PA a quattro settimane su 12 e 24 g/die del preparazione di alghe (p < 0.01)[253]. Il MAP è diminuito di 11.2 mmHg (p <0.001) nei soggetti sensibili al sodio e di 5.7 mmHg (p <0.05) nei soggetti non sensibili al sodio, che è correlato al PRA. Le alghe e gli ortaggi marini contengono la maggior parte dei 77I minerali dell'acqua di mare e degli elementi delle terre rare, fibre e alginato in forma colloidale[251-253]. L'effetto principale di Wakame sembra essere dovuto alla sua attività ACEI da almeno quattro tetrapeptidi genitori e possibilmente dai loro metaboliti dipeptidi e tripeptidi, in particolare quelli contenenti la sequenza amminoacidica Val-Tyr, Ile-Tyr, Phe-Tyr e Ile-Try in qualche combinazione[251,254,255]. Il suo uso a lungo termine in Giappone ne ha dimostrato la sicurezza. Altre varietà di alghe possono ridurre la pressione sanguigna riducendo l'assorbimento intestinale di sodio e aumentando l'assorbimento intestinale di potassio[253].
Sesamo
È stato dimostrato che il sesamo riduce la pressione arteriosa in diversi piccoli studi sull'uomo randomizzati e controllati con placebo su 30-60 giorni[256-264]. Il sesamo riduce la pressione arteriosa da solo[257-261] o in combinazione con nifedipina[256,260] diuretici e betabloccanti[257,261]. In un gruppo di 13 soggetti con ipertensione lieve, 60 mg di sesamina per 4 settimane hanno ridotto la PAS di 3.5 mmHg (p < 0.044) e la PA di 1.9 mmHg (p < 0.045)[258]. Il pasto di sesamo nero a 2.52 g/die in 4 settimane in 15 soggetti ha ridotto la PAS di 8.3 mmHg (p <0.05), ma si è verificata una riduzione non significativa della PA di 4.2 mmHg[259]. L'olio di sesamo a 35 g/die ha abbassato significativamente la PA centrale entro 1 h e ha anche mantenuto la riduzione della PA in modo cronico in 30 soggetti ipertesi, frequenza cardiaca ridotta, rigidità arteriosa ridotta, indice di aumento e velocità delle onde del polso diminuiti, HSCRP diminuito, NO migliorato, endotelina diminuita? e una migliore capacità antiossidante[264]. Inoltre, il sesamo riduce la glicemia, l'HgbAIC e il C-LDL, aumenta l'HDL, riduce i marcatori dello stress ossidativo e aumenta il glutatione, SOD, GPx, CAT, vitamine C, E e A[256,257,258-261]. I principi attivi sono ACEI naturali come sesamina, sesamolina, glucosidi di sesamminolo, lignani furoufurani che sono anche soppressori di NF-?B[262,263]. Tutti questi effetti riducono l'infiammazione e lo stress ossidativo, migliorano la difesa ossidativa e riducono la pressione arteriosa[262,263].
Bevande: tè, caffè e cacao
Tè verde, tè nero ed estratti di componenti attivi in entrambi hanno dimostrato una riduzione della PA nell'uomo[265-271]. In uno studio in doppio cieco controllato con placebo su 379 soggetti ipertesi trattati con estratto di tè verde 370 mg/die per 3 mesi, la pressione arteriosa è stata ridotta significativamente a 4/4 mmHg con una riduzione simultanea dei livelli di PCR, TNF-?, glucosio e insulina[268] .
È stato dimostrato che il cioccolato fondente (100 g) e il cacao con un alto contenuto di polifenoli (30 mg o più) riducono significativamente la PA nell'uomo[272-283]. Una metanalisi di 173 soggetti ipertesi a cui è stato somministrato cacao per una durata media di 2 settimane ha avuto una riduzione significativa della PA 4.7/2.8 mmHg (p = 0.002 per SBP e 0.006 per DBP)[276]. Quindici soggetti trattati con 100 g di cioccolato fondente con 500 mg di polifenoli per 15 giorni hanno avuto una riduzione di 6.4 mmHg della PAS (p < 0.05) con una variazione non significativa della PA[273]. Il cacao a 30 mg di polifenoli ha ridotto la pressione arteriosa nei pazienti pre-ipertensivi e in stadio di ipertensione di 2.9/1.9 mmHg a 18 settimane (p <0.001)[274]. Due più recenti meta-analisi di 13 studi e 10 studi con 297 pazienti hanno riscontrato una riduzione significativa della PA rispettivamente di 3.2/2.0 mmHg e 4.5/3.2 mmHg[276,279]. La riduzione della PA è maggiore in quelli con la PA di base più alta e in quelli con almeno il 50%-70% di cacao a dosi da 6 a 100 g/die[280,282]. Il cacao può anche migliorare la resistenza all'insulina e la funzione endoteliale[276,279,281].
I polifenoli, gli acidi clorogenici (CGA), il metabolita dell'acido ferulico dei CGA e gli acidi di-idro-caffeici riducono la pressione arteriosa in modo dose-dipendente, aumentano l'eNOS e migliorano la funzione endoteliale nell'uomo[284-286]. I CGA nel caffè verde sono stati estratti a dosi di 140 mg/die hanno ridotto significativamente la PAS e la PAS in 28 soggetti in uno studio clinico randomizzato controllato con placebo. Uno studio su 122 soggetti di sesso maschile ha dimostrato una risposta alla dose in SBP e DBP con dosi di CGA da 46 mg/die a 185 mg/die. Il gruppo che ha ricevuto la dose di 185 mg ha avuto una riduzione significativa della pressione arteriosa di 5.6/3.9 mmHg (p <0.01) in 28 giorni. L'idrossiidrochinone è un altro componente dei chicchi di caffè che riduce l'efficacia dei CGA in modo dose-dipendente, il che spiega in parte i risultati contrastanti dell'ingestione di caffè sulla BP[284,286]. Inoltre, esiste una variazione genetica nell'enzima responsabile del metabolismo della caffeina che modifica l'associazione tra assunzione di caffè, quantità di caffè ingerita e rischio di ipertensione, frequenza cardiaca, infarto miocardico, rigidità arteriosa, riflessi delle onde arteriose e livelli di catecolamine urinarie[287] . Cinquantanove per cento della popolazione ha il? Allele F/?A del genotipo CYP1A2 che conferisce un metabolismo lento della caffeina. I forti bevitori di caffè che sono metabolizzatori lenti hanno avuto 3.00 HR per lo sviluppo di ipertensione. Al contrario, metabolizzatori veloci con il?A/? Un allele ha 0.36 HR per l'ipertensione incidente[288].
Composti aggiuntivi
La melatonina dimostra significativi effetti anti-ipertensivi negli esseri umani in numerosi studi clinici randomizzati in doppio cieco controllati con placebo a 3-5 mg/die[289-299]. La riduzione media della PA è di 6/3 mmHg. La melatonina stimola i recettori GABA nel SNC e i recettori vascolari della melatonina, inibisce il plasma A ? livelli, migliora la funzione endoteliale, aumenta l'NO, vasodilata, migliora l'immersione notturna, abbassa il cortisolo ed è additivo con gli ARB. I beta-bloccanti riducono la secrezione di melatonina[300].
L'esperidina ha ridotto significativamente la DBP 3-4 mmHg (p <0.02) e ha migliorato la reattività endoteliale microvascolare in 24 soggetti di sesso maschile ipertesi obesi in uno studio crossover controllato e randomizzato su 4 settimane per ciascuno dei tre gruppi di trattamento che consumavano 500 ml di succo d'arancia, esperidina o placebo [301].
Il succo di melograno è ricco di tannini e possiede numerose altre proprietà che migliorano la salute vascolare e riducono la SBP del 5%-12%[302,303]. Uno studio su 51 soggetti sani trattati con 330 mg/die di succo di melograno ha avuto una riduzione della PA di 3.14/2.33 mmHg (p <0.001)[303]. Il succo di melograno sopprime anche l'aumento postprandiale della PAS dopo un pasto ricco di grassi[303]. Il succo di melograno riduce l'attività dell'ACE sierico del 36% e ha effetti antiaterogeni, antiossidanti e antinfiammatori[302,303]. Il succo di melograno a 50 ml/die ha ridotto l'IMT carotideo del 30% in un anno, aumentato PON 83%, ridotto oxLDL del 59%-90%, diminuito gli anticorpi contro oxLDL del 19%, aumentato stato antiossidante totale del 130%, ridotto TGF- ?, aumento della catalasi, SOD e GPx, aumento di eNOS e NO e miglioramento della funzione endoteliale[304,305] Il succo di melograno funziona come un ACEI.
L'estratto di semi d'uva (GSE) è stato somministrato ai soggetti in nove studi randomizzati, meta-analisi di 390 soggetti e ha dimostrato una significativa riduzione della SBP di 1.54 mmHg (P <0.02) [304,305]. Una significativa riduzione della pressione arteriosa di 11/8 mmHg (P <0.05) è stata osservata in un altro studio dose-risposta con 150-300 mg / die di GSE in 4 settimane [306]. Il GSE ha un alto contenuto fenolico che attiva la via di segnalazione PI3K / Akt che fosforila eNOS e aumenta l'NO [306,307].
Coenzima Q10 (Ubichinone)
Il coenzima Q10 ha effetti antipertensivi consistenti e significativi nei pazienti con ipertensione essenziale[1,308-317]. La letteratura è riassunta di seguito: (1) Rispetto ai pazienti normotesi, i pazienti ipertesi essenziali hanno una maggiore incidenza (6 volte) di carenza di coenzima Q10 documentata dai livelli sierici[1]; (2) Dosi da 120 a 225 mg/die di coenzima Q10, a seconda del metodo di somministrazione o dell'ingestione concomitante con un pasto grasso, sono necessarie per raggiungere un livello terapeutico di 3 ug/ml[1,313,314]. Questa dose è solitamente di 3-5 mg/kg al giorno di coenzima Q10. I livelli di dosaggio orale possono diminuire con i sistemi di rilascio di nanoparticelle ed emulsioni destinati a facilitare l'assorbimento[315]. Gli effetti avversi non sono stati caratterizzati in letteratura; (3) I pazienti con i livelli sierici di coenzima Q10 più bassi possono avere la migliore risposta antipertensiva all'integrazione; (4) La riduzione media della pressione arteriosa è di circa 15/10 mmHg e la frequenza cardiaca scende di 5 battiti/min sulla base degli studi e delle metanalisi riportati; (5) L'effetto antipertensivo impiega del tempo per raggiungere il suo livello massimo a 4 settimane. Quindi la pressione arteriosa rimane stabile durante il trattamento a lungo termine. L'effetto antipertensivo scompare entro due settimane dall'interruzione del coenzima Q10. La riduzione della PA e della SVR sono correlate ai livelli sierici pre e post trattamento del coenzima Q10. Circa il 50% dei pazienti risponde alla supplementazione orale di coenzima Q10 per la PA[309]; (6) Circa il 50% dei pazienti in trattamento con farmaci antipertensivi può essere in grado di sospendere da uno a tre agenti. Sia la dose totale che la frequenza di somministrazione possono essere ridotte. (7) I pazienti a cui è stato somministrato il coenzima Q10 con enalapril hanno migliorato l'ABM nelle 24 ore meglio rispetto all'enalapril in monoterapia e hanno anche normalizzato la funzione endoteliale[310]; e (8) il coenzima Q10 è un antiossidante della fase lipidica e scavenger dei radicali liberi, aumenta eNOS e NO, riduce l'infiammazione e NF-?B e migliora la funzione endoteliale e l'elasticità vascolare[1,311,312].
Altri effetti favorevoli sui fattori di rischio cardiovascolare comprendono miglioramento del profilo lipidico sierico e metabolismo dei carboidrati con riduzione del glucosio e miglioramento della sensibilità all'insulina, riduzione dello stress ossidativo, riduzione della frequenza cardiaca, miglioramento della funzione del miocardio LV e del rilascio di ossigeno e diminuzione dei livelli di catecolamina [1,311,312].
Acido alfa lipoico
L'acido alfa lipoico (ALA) è noto come acido lipoico in Europa, dove è un farmaco di prescrizione. È un composto contenente zolfo con attività antiossidante sia in fase acquosa che lipidica[1,70,71]. Il suo utilizzo è ormai consolidato nel trattamento di alcune forme di epatopatia e nel ritardo dell'insorgenza di neuropatia periferica nei pazienti diabetici. Recenti ricerche hanno valutato il suo ruolo potenziale nel trattamento dell'ipertensione, in particolare come parte della SM[318-321]. In uno studio incrociato in doppio cieco su 36 pazienti di oltre 8 settimane con CHD e ipertensione, 200 mg di acido lipoico con 500 mg di acetil-L-carnitina hanno ridotto significativamente la PA di 7/3 mmHg e aumentato il diametro dell'arteria brachiale[320]. Lo studio QUALITY su 40 pazienti con DM e ipertensione allo stadio iniziale ha mostrato miglioramenti significativi della pressione arteriosa, dell'escrezione urinaria di albumina, dell'afta epizootica e della sensibilità all'insulina in 8 settimane con una combinazione di quinapril (40 mg/die) e acido lipoico (600 mg/die) che era maggiore di entrambi i soli[320]. L'acido lipoico aumenta i livelli di glutatione, cisteina, vitamina C e vitamina E, inibisce NF-?B, riduce l'endotelina-1, il fattore tissutale e VCAM-1, aumenta il cAMP, sottoregola l'espressione immunitaria CD4 sulle cellule mononucleate, riduce lo stress ossidativo, l'infiammazione, riduce l'aterosclerosi nei modelli animali, diminuisce le aldeidi sieriche e chiude i canali del calcio che migliora la vasodilatazione, aumenta l'NO e i nitrosotioli, migliora la funzione endoteliale e abbassa la PA[1,318-321]. L'acido lipoico normalizza i canali del calcio di membrana fornendo gruppi sulfidrilici, diminuendo il calcio libero citosolico e abbassando la SVR. Inoltre, l'acido lipoico migliora la sensibilità all'insulina che abbassa il glucosio e i prodotti finali della glicosilazione avanzata che migliorano il controllo della pressione arteriosa e abbassano i trigliceridi sierici. Morcos et al[321], hanno mostrato una stabilizzazione dell'escrezione urinaria di albumina in soggetti DM trattati con 600 mg di ALA rispetto al placebo per 18 mesi (p <0.05).
La dose raccomandata è da 100 a 200 mg/die di acido R-lipoico con biotina 2-4 mg/die per prevenire l'esaurimento della biotina con l'uso a lungo termine di acido lipoico. L'acido R-lipoico è preferito all'isomero L a causa del suo uso preferito da parte dei mitocondri[1,32,71]. NAC: NAC e L arginina (ARG) in combinazione riducono l'attivazione endoteliale e la PA nei pazienti ipertesi con DM di tipo 2[141]. Oltre 6 mesi, 24 soggetti trattati con placebo o NAC con ARG, hanno ridotto significativamente sia la pressione sistolica che quella diastolica (p = 0.05)[141]. Inoltre, LDL di bue, HSCRP, ICAM, VCAM, fibrinogeno e PAI-1 erano diminuiti mentre aumentavano HDL, NO e vasodilatazione endoteliale postischemica[141]. Il NAC aumenta l'NO tramite IL-1b e aumenta l'iNOS MRNA, aumenta il glutatione aumentando i livelli di cisteina, riduce l'affinità per il recettore AT1 interrompendo i gruppi disolfuro, blocca il canale del calcio di tipo L, abbassa l'omocisteina e migliora l'IMT[141,322-324]. La dose raccomandata è da 500 a 1000 mg bid. L'estratto di biancospino è stato usato per secoli per il trattamento dell'ipertensione, dell'insufficienza cardiaca congestizia e di altre malattie cardiovascolari[325-329]. Un recente disegno crossover a quattro periodi, studio dose-risposta in 21 soggetti con preipertensione o ipertensione lieve oltre 3 giorni, non ha mostrato cambiamenti nell'afta epizootica o nella pressione arteriosa su estratto standardizzato con 50 mg di procianidina oligomerica per 250 mg di estratto con 1000 mg, 1500 o 2500 mg dell'estratto[325]. Hawthorne ha mostrato non inferiorità di ACEI e diuretici nel trattamento di
NAC: NAC e L arginina (ARG) in combinazione riducono l'attivazione endoteliale e la PA nei pazienti ipertesi con tipo 2 DM [141]. Oltre i soggetti 6 mo 24 trattati con placebo o NAC con ARG, hanno ridotto significativamente sia la pressione sistolica che diastolica (p = 0.05) [141]. Inoltre, LDL di bue, HSCRP, ICAM, VCAM, fibrinogeno e PAI-1 sono diminuiti mentre aumentano HDL, NO e vasodilatazione postischemica endoteliale [141]. NAC aumenta NO via IL-1b e aumenta iNOS MRNA, aumenta il glutatione aumentando i livelli di cisteina, riduce l'affinità per il recettore AT1 interrompendo gruppi di disolfuro, blocca il canale del calcio di tipo L, abbassa l'omocisteina e migliora l'IMT [141,322-324]. La dose raccomandata è 500 a 1000 mg bid.
L'estratto di biancospino è stato usato per secoli per il trattamento dell'ipertensione, dell'insufficienza cardiaca congestizia e di altre malattie cardiovascolari[325-329]. Un recente disegno crossover a quattro periodi, studio dose-risposta in 21 soggetti con preipertensione o ipertensione lieve oltre 3 giorni, non ha mostrato cambiamenti nell'afta epizootica o nella pressione arteriosa su estratto standardizzato con 50 mg di procianidina oligomerica per 250 mg di estratto con 1000 mg, 1500 o 2500 mg dell'estratto[325]. Hawthorne ha mostrato la non inferiorità di ACEI e diuretici nel trattamento di 102 pazienti con NYHC? CHF oltre 8 sett.[327]. I pazienti con ipertensione e DM di tipo 2 in trattamento con farmaci per PA e DM sono stati randomizzati a 1200 mg di estratto di biancospino per 16 settimane hanno mostrato riduzioni significative della DBP di 2.6 mmHg (p = 0.035)[328]. A trentasei pazienti lievemente ipertesi sono stati somministrati 500 mg di estratto di biancospino per 10 settimane e hanno mostrato un trend non significativo nella riduzione della DBP (p = 0.081) rispetto al placebo[329]. Hawthorne agisce come un ACEI, BB, CCB e diuretico. Sono necessari ulteriori studi per determinare l'efficacia, gli effetti a lungo termine e la dose di biancospino per il trattamento dell'ipertensione.
La quercetina è un flavonolo antiossidante presente nelle mele, nei frutti di bosco e nelle cipolle che riduce la pressione arteriosa negli individui ipertesi[330,331] ma gli effetti ipotensivi non sembrano essere mediati da variazioni di HSCRP, TNF-?, attività ACE, ET-1, NO, attività vascolare reattività o afta epizootica[330]. La quercetina è metabolizzata dal CYP 3A4. La quercetina è stata somministrata a 12 uomini ipertesi a una dose orale di 1095 mg con riduzione della PA media di 5 mmHg, SBP di 7 mmHg e DBP di 3 mmHg[330]. Il livello plasmatico massimo a 10 h era 2.3 ± 1.8 µmol/L, con ritorno ai livelli basali a 17 h. Quarantuno soggetti pre-ipertensivi e in stadio di ipertensione sono stati arruolati in uno studio crossover randomizzato, in doppio cieco, controllato con placebo con 730 mg di quercetina al giorno vs placebo[331]. Nei pazienti in stadio ipertensivo, la pressione arteriosa è stata ridotta di 7/5 mmHg (p < 0.05) ma non si sono verificati cambiamenti nei marker di stress ossidativo[331]. La quercetina somministrata a 93 soggetti in sovrappeso o obesi a 150 mg/die (livelli plasmatici di 269 nmol/L) nell'arco di 6 settimane ha ridotto la PAS di 2.9 mmHg nel gruppo iperteso e fino a 3.7 mmHg di PAS nei pazienti di età compresa tra 25 e 50 anni[ 332]. La dose raccomandata di quercetina è 500 mg bid.
CONSIDERAZIONI CLINICHE
Combinare cibo e sostanze nutritive con farmaci
Molte delle combinazioni strategiche di integratori nutraceutici insieme o con farmaci antipertensivi, hanno dimostrato di abbassare la pressione sanguigna più del farmaco da solo: (1) sesamo con betabloccanti, diuretici e nifedipina; (2) Picnogenolo con ACEI e CCB; (3) Licopene con ACEI, CCB e diuretici; (4) ALA con ACEI o acetil -L Carnitina; (5) Vitamina C con CCB; (6) NAC con arginina; (7) Aglio con ACEI, diuretici e betabloccanti; (8) Coenzima Q10 con ACEI e CCB; (9) Taurina con magnesio; (10) Potassio con tutti gli agenti antipertensivi; e (11) Magnesio con tutti gli agenti antipertensivi.
Molti farmaci antipertensivi possono causare deplezioni di nutrienti che possono effettivamente interferire con la loro azione antipertensiva o causare altri effetti metabolici avversi che si manifestano attraverso il laboratorio o con sintomi clinici[333]. I diuretici riducono potassio, magnesio, fosforo, sodio, cloruro, folato, vitamina B6, zinco, iodio e coenzima Q10; aumentare l'omocisteina, il calcio e la creatinina; ed elevare la glicemia inducendo la resistenza all'insulina. I beta-bloccanti riducono il coenzima Q10. ACEI e ARB riducono lo zinco.
La biologia vascolare come l'endoteliale e la VSMD gioca un ruolo primario nell'iniziazione e perpetuazione dell'ipertensione, CVD e TOD. Interazioni di geni nutritivi ed epigenetica sono un fattore predominante nel promuovere effetti benefici o dannosi nella salute cardiovascolare e nell'ipertensione. Cibo e sostanze nutritive possono prevenire, controllare e trattare l'ipertensione attraverso numerosi meccanismi di biologia vascolare. Lo stress ossidativo, l'infiammazione e la disfunzione autoimmune iniziano e propagano l'ipertensione e le malattie cardiovascolari. c'è un ruolo per l'uso selezionato di supplementi nutraceutici singoli e componenti vitamine, antiossidanti e minerali nel trattamento dell'ipertensione basata su studi scientificamente controllati come complemento all'assunzione ottimale nutrizionale e dietetica dal cibo e da altre modifiche dello stile di vita [333]. Un approccio clinico che comprende dieta, alimenti, sostanze nutritive, esercizio fisico, riduzione del peso, cessazione dell'abitudine al fumo, restrizione di alcol e caffeina e altre strategie di stile di vita può essere sistematicamente e correttamente integrato nella pratica clinica (Tabella 4).
Conclusione nutraceutica:
La biologia vascolare, la muscolatura liscia endoteliale e vascolare e la disfunzione cardiaca svolgono un ruolo primario nell'iniziazione e perpetuazione dell'ipertensione, delle malattie cardiovascolari e della TOD. Interazioni di geni nutritivi ed epigenetica sono fattori predominanti nel promuovere effetti benefici o dannosi nella salute cardiovascolare e nell'ipertensione. Macronutrienti e micronutrienti possono prevenire, controllare e trattare l'ipertensione attraverso numerosi meccanismi legati alla biologia vascolare. Lo stress ossidativo, l'infiammazione e la disfunzione autoimmune iniziano e propagano l'ipertensione e le malattie cardiovascolari. Vi è un ruolo per l'uso selezionato di integratori nutraceutici singoli e componenti, vitamine, antiossidanti e minerali nel trattamento dell'ipertensione sulla base di studi scientificamente controllati che completano l'ottimale nutrizione, insieme ad altre modifiche allo stile di vita.
vuoto
Riferimenti:
1 Houston MC. Trattamento dell'ipertensione con nutraceutici, vitamine, antiossidanti e minerali. Expert Rev Cardiovasc Ther 2007; 5: 681-691 [PMID: 17605647 DOI: 10.1159/000098012]
2 Eaton SB, Eaton SB, Konner MJ. Nutrizione paleolitica rivisitata:
una retrospettiva di dodici anni sulla sua natura e le sue implicazioni.
Eur J Clin Nutr 1997; 51: 207-216 [PMID: 9104571 DOI:
10.1038 / sj.ejcn.1600389]
3 Houston MC, Harper KJ. Potassio, magnesio e calcio:
il loro ruolo sia nella causa che nel trattamento dell'ipertensione.
J Clin Hypertens (Greenwich) 2008; 10: 3-11 [PMID:
18607145 DOI: 10.1111 / j.1751-7176.2008.08575.x]
4 Layne J, Majkova Z, Smart EJ, Toborek M, Hennig B. Caveolae:
una piattaforma normativa per la modulazione nutrizionale dell'infiammazione
malattie. J Nutr Biochem 2011; 22: 807-811 [PMID:
21292468 DOI: 10.1016 / j.jnutbio.2010.09.013]
5 Dandona P, Ghanim H, Chaudhuri A, Dhindsa S, Kim SS.
L'assunzione di Macronutrienti induce l'ossidazione e l'infiammazione
stress: potenziale rilevanza per l'aterosclerosi e l'insulina
resistenza. Exp Mol Med 2010; 42: 245-253 [PMID: 20200475
DOI: 10.3858 / emm.2010.42.4.033]
6 Berdanier CD. Interazioni del gene nutritivo. In: Ziegler EE,
Filer LJ Jr, eds. Conoscenza attuale in nutrizione, 7th Ed.
Washington. DC: ILSI Press. 1996: 574-580
7 Talmud PJ, Waterworth DM. Nutrientene in vivo e in-vitro
interazioni. Curr Opin Lipidol 2000; 11: 31-36 [PMID:
10750691 DOI: 10.1097/00041433-200002000-00005]
8 Lundberg AM, Yan ZQ. Recettori per il riconoscimento immunitario innato
e modelli molecolari associati al danno nella placca
infiammazione. Curr Opin Lipidol 2011; 22: 343-349 [PMID:
21881501 DOI: 10.1097/MOL.0b013e32834ada80]
9 Zhao L, Lee JY, Hwang DH. Inibizione del riconoscimento di pattern
infiammazione mediata dai recettori da sostanze fitochimiche bioattive.
Nutr Rev 2011; 69: 310-320 [PMID: 21631512 DOI:
10.1111 / j.1753-4887.2011.00394.x]
10 Houston MC. L'importanza del potassio nella gestione
ipertensione. Curr Hypertens Rep 2011; 13: 309-317 [PMID:
21403995 DOI: 10.1007/s11906-011-0197-8]
11 Broadhurst CL. Assunzioni bilanciate di trigliceridi naturali per
nutrizione ottimale: una prospettiva evolutiva e fitochimica.
Med Hypotheses 1997; 49: 247-261 [PMID: 9293470
DOI: 10.1016/S0306-9877(97)90210-3]
12 Eftekhari A, Mathiassen ON, Buus NH, Gotzsche O, Mulvany
MJ, Christensen KL. Microvascolare sproporzionato
struttura in ipertensione essenziale. J Hypertens
2011; 29: 896-905 [PMID: 21330935 DOI: 10.1097/ HJH.0b013e
3283447a1c]
13 Touyz RM. Nuove conoscenze sui meccanismi dell'ipertensione.
Curr Opin Nephrol Hypertens 2012; 21: 119-121 [PMID:
22257800 DOI: 10.1097/MNH.0b013e328350a50f]
14 Xing T, Wang F, Li J, Wang N. Ipertensione: immunologica
malattia? J Hypertens 2012; 30: 2440-2441 [PMID:
23151885 DOI: 10.1097/HJH.0b013e32835953f9]
15 Giannattasio C, Cattaneo BM, Mangoni AA, Carugo S, Stella
ML, Failla M, Trazzi S, Sega R, Grassi G, Mancia G. Cardiac
e cambiamenti strutturali vascolari in soggetti normotesi
con ipertensione parentale. J Hypertens 1995; 13: 259-264
[PMID: 7615957]
16 Goncharov A, Bloom M, Pavuk M, Birman I, Carpenter
FARE. Pressione sanguigna e ipertensione in relazione ai livelli di
bifenili policlorurati sierici nei residenti di Anniston,
Alabama. J Hypertens 2010; 28: 2053-2060 [PMID: 20644494]
17 Houston MC. Ruolo della tossicità del mercurio nell'ipertensione, cardiovascolare
malattia e ictus. J Clin Hypertens (Greenwich)
2011; 13: 621-627 [PMID: 21806773]
18 Al-Ghamdi A. Ruolo del virus dell'herpes simplex-1, citomegalovirus
e virus di Epstein-Barr nell'aterosclerosi. Pak J Pharm
Sci 2012; 25: 89-97 [PMID: 22186314]
19 Kotronias D, virus di Kapranos N. Herpes simplex come determinante
fattore di rischio per l'aterosclerosi dell'arteria coronaria
e infarto del miocardio. In Vivo 2005; 19: 351-357 [PMID:
15796197]
20 Grahame-Clarke C, Chan NN, Andrew D, Ridgway GL,
Betteridge DJ, Emery V, Colhoun HM, Vallance P. Human
la sieropositività da citomegalovirus è associata a compromissione
funzione vascolare. Circolazione 2003; 108: 678-683 [PMID:
12900349 DOI: 10.1161/01.CIR.0000084505.54603.C7]
21 Nayak DU, Karmen C, Frishman WH, Vakili BA. antiossidante
vitamine e derivati enzimatici e sintetici a base di ossigeno
spazzini di radicali liberi nella prevenzione e nel trattamento
di malattie cardiovascolari. Heart Dis 2001; 3: 28-45 [PMID:
11975768 DOI: 10.1097/00132580-200101000-00006]
22 Kizhakekuttu TJ, Widlansky ME. Antiossidanti naturali e
ipertensione: promessa e sfide. Cardiovasc Ther 2010;
28: e20-e32 [PMID: 20370791 DOI: 10.1111/ j.1755-5922.2010.0
0137.x]
23 Kitiyakara C, Wilcox CS. Antiossidanti per l'ipertensione.
Curr Opin Nephrol Hypertens 1998; 7: 531-538 [PMID: 9818200
DOI: 10.1097 / 00041552-199809000-00008]
24 Russo C, Olivieri O, Girelli D, Faccini G, Zenari ML, Lombardi
S, Corrocher R. Stato antiossidante e perossidazione lipidica
in pazienti con ipertensione essenziale. J Hypertens 1998;
16: 1267-1271 [PMID: 9746113 DOI: 10.1097 / 00004872-199816
090-00007]
25 Tse WY, Maxwell SR, Thomason H, Blann A, Thorpe GH,
Waite M, Holder R. Stato antiossidante in controllato e
ipertensione incontrollata e la sua relazione con l'endoteliale
danno. J Hum Hypertens 1994; 8: 843-849 [PMID: 7853328]
26 Mansego ML, Solar Gde M, Alonso MP, Mart nez F, S ez
GT, Escudero JC, Redn J, Chaves FJ. Polimorfismi di antiossidante
enzimi, pressione arteriosa e rischio di ipertensione.
J Hypertens 2011; 29: 492-500 [PMID: 21178785 DOI: 10.1097 /
HJH.0b013e328341f1b2]
27 Galley HF, Thornton J, Howard PD, Walker BE, Webster
NR. La combinazione di antiossidanti per via orale si riduce
pressione sanguigna. Clin Sci (Lond) 1997; 92: 361-365 [PMID:
9176034]
28 Dhalla NS, Temsah RM, Netticadan T. Ruolo dell'ossidativo
stress nelle malattie cardiovascolari. J Hypertens 2000; 18: 655-673
[PMID: 10872549 DOI: 10.1097 / 00004872-200018060-00002]
29 Saez G, Tormos MC, Giner V, Lorano JV, Chaves FJ, Armengod
ME, Redon J. P-653: stress ossidativo ed enzimatico
meccanismi antiossidanti nell'ipertensione essenziale. Am J Hypertens
2001; 14: 248A [DOI: 10.1016/S0895-7061(01)01983-5]
30 Nishihara M, Hirooka Y, Matsukawa R, Kishi T, Sunagawa
K. Lo stress ossidativo nel midollo ventrolaterale rostrale modula
input eccitatori e inibitori in caso di ipertensione spontanea
ratti. J Hypertens 2012; 30: 97-106 [PMID: 22157590
DOI: 10.1097/HJH.0b013e32834e1df4]
31 Konno S, Hirooka Y, Kishi T, Sunagawa K. Sympathoinhibitory
effetti del telmisartan attraverso la riduzione dell'ossidativo
stress nel midollo ventrolaterale rostrale dell'obesità
ratti ipertesi. J Hypertens 2012; 30: 1992-1999 [PMID:
22902874 DOI: 10.1097/HJH.0b013e328357fa98]
32 Ghanem FA, Movahed A. Infiammazione in alta pressione sanguigna:
una prospettiva da un medico. J Am Soc Hypertens 2007; 1:
113-119 [PMID: 20409841 DOI: 10.1016 / j.jash.2007.01.004]
33 Amer MS, Elawam AE, Khater MS, Omar OH, Mabrouk RA,
Taha HM. Associazione di proteine C-reattive ad alta sensibilità
con spessore intima-media dell'arteria carotide in iperteso
gli anziani J Am Soc Hypertens 2011; 5: 395-400 [PMID:
21524639]
34 Vongpatanasin W, Thomas GD, Schwartz R, Cassis LA,
Osborne-Lawrence S, Hahner L, Gibson LL, Black S, Samols
D, Shaul PW. La proteina C-reattiva causa una downregulation di
recettori vascolari dell'angiotensina 2 e ipertensione sistolica
nei topi. Circolazione 2007; 115: 1020-1028 [PMID:
17283257 DOI: 10.1161 / CIRCULATIONAHA.106.664854]
35 Razzouk L, Muntner P, Bansilal S, Kini AS, Aneja A, Mozes
J, Ivan O, Jakkula M, Sharma S, Farkouh ME. C-reattiva
la proteina predice la mortalità a lungo termine indipendentemente dalla bassa densità
colesterolo lipoproteico in pazienti sottoposti a intervento coronarico percutaneo. Am Heart J 2009; 158: 277-283 [PMID: 19619706 DOI: 10.1016 / j.ahj.2009.05.026]
36 Kvakan H, Luft FC, Muller DN. Ruolo del sistema immunitario
nel danno dell'organo bersaglio ipertensivo. Tendenze Cardiovasc Med
2009; 19: 242-246 [PMID: 20382349 DOI: 10.1016/ j. tcm.2010.02.
004]
37 Rodrüguez-Iturbe B, Franco M, Tapia E, Quiroz Y, Johnson
RJ. Infiammazione renale, autoimmunità e ipertensione sale-sensibile.
Clin Exp Pharmacol Physiol 2012; 39: 96-103 [PMID:
21251049 DOI: 10.1111 / j.1440-1681.2011.05482.x]
38 Tian N, Penman AD, Mawson AR, Manning RD, Flessner
MF. Associazione tra tipi di leucociti specifici circolanti
e pressione sanguigna: il rischio di aterosclerosi nelle comunità
(ARIC) studio. J Am Soc Hypertens 2010; 4: 272-283 [PMID:
20980213 DOI: 10.1016 / j.jash.2010.09.005]
39 Muller DN, Kvakan H, Luft FC. Effetti immuno-correlati in
ipertensione e danno dell'organo bersaglio. Curr Opin Nephrol
Hypertens 2011; 20: 113-117 [PMID: 21245763 DOI: 10.1097 /
MNH.0b013e3283436f88]
40 Marketou ME, Kontaraki JE, Zacharis EA, Kochiadakis GE,
Giaouzaki A, Chlouverakis G, Vardas PE. TLR2 e TLR4
espressione genica nei monociti periferici in non diabetici
pazienti ipertesi: l'effetto della pressione sanguigna intensiva.
J Clin Hypertens (Greenwich) 2012; 14: 330-335
[PMID: 22533660 DOI: 10.1111 / j.1751-7176.2012.00620.x]
41 Luft FC. La regolazione neurale del sistema immunitario modula
danno d'organo-bersaglio indotto dall'ipertensione. J Am Soc Hypertens
2012; 6: 23-26 [PMID: 22047671 DOI: 10.1016/ j. jash.2011.
09.006]
42 Herrada AA, Campino C, Amador CA, Michea LF, Fardella
CE, Kalergis AM. Aldosterone come modulatore dell'immunità:
implicazioni nel danno d'organo. J Hypertens 2011; 29:
1684-1692 [PMID: 21826023 DOI: 10.1097/ HJH.0b013e32834a
4c75]
43 Colussi G, Catena C, Sechi LA. Spironolattone, eplerenone
e i nuovi bloccanti aldosterone in endocrino e primario
ipertensione. J Hypertens 2013; 31: 3-15 [PMID: 23011526
DOI: 10.1097/HJH.0b013e3283599b6a]
44 Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP,
Sacchi FM, Bray GA, Vogt TM, Cutler JA, Windhauser MM,
Lin PH, Karanja N. Una sperimentazione clinica degli effetti della dieta
modelli sulla pressione sanguigna. DASH Ricerca collaborativa
Gruppo. N Engl J Med 1997; 336: 1117-1124 [PMID: 9099655]
45 Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA,
Harsha D, Obarzanek E, Conlin PR, Miller ER, SimonsMorton
DG, Karanja N, Lin PH. Effetti sulla pressione sanguigna
di sodio dietetico ridotto e gli approcci dietetici a
Stop alla dieta ipertensione (DASH). DASH-Sodium Collaborative
Gruppo di ricerca. N Engl J Med 2001; 344: 3-10 [PMID:
11136953]
46 Sun B, Williams JS, Svetkey LP, Kolatkar NS, Conlin PR.
Il genotipo del recettore adrenergico Beta2 colpisce il reninangiotensin-aldosterone
risposta del sistema agli approcci dietetici
per fermare la dieta ipertensione (DASH). am
J Clin Nutr 2010; 92: 444-449 [PMID: 20519561 DOI: 10.3945 /
ajcn.2009.28924]
47 Chen Q, Turban S, Miller ER, Appel LJ. Gli effetti della dieta
modelli sull'attività della renina plasmatica: risultati dal Dietetico
Approcci per fermare la prova di ipertensione. J Hum Hypertens
2012; 26: 664-669 [PMID: 22048714 DOI: 10.1038 / jhh.2011.87]
48 Al-Solaiman Y, Jesri A, Zhao Y, Morrow JD, Egan BM. Basso contenuto di sodio
DASH riduce lo stress ossidativo e migliora i vasi
funzione in esseri umani sensibili al sale. J Hum Hypertens 2009;
23: 826-835 [PMID: 19404315 DOI: 10.1038 / jhh.2009.32]
49 Lin PH, Allen JD, Li YJ, Yu M, Lien LF, Svetkey LP. Sangue
Meccanismi di abbassamento della pressione del modello dietetico DASH.
J Nutr Metab 2012; 2012: 472396 [PMID: 22496969 DOI:
10.1155 / 2012 / 472396]
50 Kotchen TA, McCarron DA. Elettroliti dietetici e sangue
pressione: una dichiarazione per gli operatori sanitari dal
American Nutrition Association. Circolazione
1998; 98: 613-617 [PMID: 9714124]
51 Cutler JA, Follmann D, Allender PS. Prove randomizzate di
riduzione del sodio: una panoramica. Am J Clin Nutr 1997; 65:
643S-651S [PMID: 9022560]
52 Svetkey LP, Sacks FM, Obarzanek E, Vollmer WM, Appel
LJ, Lin PH, Karanja NM, Harsha DW, Bray GA, Aickin M,
Proschan MA, Windhauser MM, Swain JF, McCarron PB,
Rhodes DG, Laws RL. La dieta DASH, assunzione di sodio e
Prova di pressione sanguigna (DASH-sodio): logica e design.
DASH-Sodium Collaborative Research Group. J Am Diet Assoc
1999; 99: S96-104 [PMID: 10450301 DOI: 10.1016 / S0002-
8223 (99) 00423-X]
53 Kawada T, Suzuki S. Attenzione alla prevenzione del sale da prevenire
ipertensione nei giovani. J Clin Hypertens (Greenwich)
2011; 13: 933-934 [PMID: 22142354 DOI: 10.1111/ j.1751-7176.
2011.00555.x]
54 Weinberger MH. Sensibilità salina della pressione arteriosa nell'uomo.
Ipertensione 1996; 27: 481-490 [PMID: 8613190 DOI:
10.1161 / 01.HYP.27.3.481]
55 Morimoto A, Uzu T, Fujii T, Nishimura M, Kuroda S, Nakamura
S, Inenaga T, Kimura G. Sensibilità al sodio e cardiovascolare
eventi in pazienti con ipertensione essenziale.
Lancet 1997; 350: 1734-1737 [PMID: 9413464]
56 Tomonari T, Fukuda M, Miura T, Mizuno M, Wakamatsu
TY, Ichikawa T, Miyagi S, Shirasawa Y, Ito A, Yoshida A,
Omori T, Kimura G. L'assunzione di sale è un fattore di rischio indipendente
di mortalità per ictus? Analisi demografica per regioni in
Giappone. J Am Soc Hypertens 2011; 5: 456-462 [PMID: 21890446
DOI: 10.1016 / j.jash.2011.07.004]
57 Kanbay M, Chen Y, Solak Y, Sanders PW. Meccanismi e
conseguenze della sensibilità del sale e dell'assunzione di sale nella dieta. curr
Opin Nephrol Hypertens 2011; 20: 37-43 [PMID: 21088577 DOI:
10.1097/MNH.0b013e32834122f1]
58 Dubach JM, Das S, Rosenzweig A, Clark HA. Visualizzazione di sodio
dinamica in cardiomiociti isolati usando fluorescenza
nanosensori. Proc Natl Acad Sci USA 2009; 106: 16145-16150
[PMID: 19805271 DOI: 10.1073 / pnas.0905909106]
59 Oberleithner H, Callies C, Kusche-Vihrog K, Schillers H,
Shahin V, Riethmüller C, Macgregor GA, de Wardener HE.
Il potassio ammorbidisce l'endotelio vascolare e aumenta il nitrico
rilascio di ossido. Proc Natl Acad Sci USA 2009; 106: 2829-2834
[PMID: 19202069 DOI: 10.1073 / pnas.0813069106]
60 Oberleithner H, Riethmüller C, Schillers H, MacGregor GA,
de Wardener HE, Hausberg M. Il plasma di sodio si irrigidisce vascolare
endotelio e riduce il rilascio di ossido nitrico. Proc. Nat
Acad Sci USA 2007; 104: 16281-16286 [PMID: 17911245 DOI:
10.1073 / pnas.0707791104]
61 Fels J, Oberleithner H, Kusche-Vihrog K. M nage trois: aldosterone,
sodio e ossido nitrico nell'endotelio vascolare.
Biochim Biophys Acta 2010; 1802: 1193-1202 [PMID: 20302930
DOI: 10.1016 / j.bbadis.2010.03.006]
62 Oberleithner H, Kusche-Vihrog K, Schillers H. Endothelial
cellule come sensori del sale vascolare. Kidney Int 2010; 77: 490-494
[PMID: 20054292 DOI: 10.1038 / ki.2009.490]
63 Kusche-Vihrog K, Callies C, Fels J, Oberleithner H. The
canale epiteliale del sodio (ENaC): mediatore dell'aldosterone
risposta nell'endotelio vascolare? steroidi
2010; 75: 544-549 [PMID: 19778545 DOI: 10.1016/ j.steroids.2009.09.003]
64 Fels J, Callies C, Kusche-Vihrog K, Oberleithner H. Nitric
il rilascio di ossido segue la nanomeccanica endoteliale e non
vice versa. Pflugers Arch 2010; 460: 915-923 [PMID: 20809399
DOI: 10.1007/s00424-010-0871-8]
65 Callies C, Fels J, Liashkovich I, Kliche K, Jeggle P, KuscheVihrog
K, Oberleithner H. Membrana potenziale depolarizzazione
diminuisce la rigidità delle cellule endoteliali vascolari. J
Cell Sci 2011; 124: 1936-1942 [PMID: 21558418 DOI: 10.1242 /
jcs.084657]
66 Kusche-Vihrog K, Urbanova K, Blanqu A, Wilhelmi M,
Schillers H, Kliche K, Pavenst dt H, Brand E, Oberleithner
H. La proteina C-reattiva rende l'endotelio umano rigido e teso. Ipertensione 2011; 57: 231-237 [PMID: 21149827 DOI: 10.1161 / HYPERTENSIONAHA.110.163444]
67 Foulquier S, Dupuis F, Perrin-Sarrado C, Maguin Gat K,
Merhi-Soussi F, Liminana P, Kwan YW, Capdeville-Atkinson
C, Lartaud I, Atkinson J. L'alta assunzione di sale abolisce AT (2) -
vasodilatazione mediata delle arteriole piali nei ratti. J Hypertens
2011; 29: 1392-1399 [PMID: 21519278 DOI: 10.1097/ HJH.0b01
3e328347050e]
68 Kusche-Vihrog K, Oberleithner H. Un concetto emergente di
sensibilità vascolare del sale F1000 Biol Rep 2012; 4: 20 [PMID:
23112808 DOI: 10.3410 / B4-20]
69 Popov S, Silveira A, W gs ter D, Takemori H, Oguro R,
Matsumoto S, Sugimoto K, Kamide K, Hirose T, Satoh M,
Metoki H, Kikuya M, Ohkubo T, Katsuya T, Rakugi H, Imai
Y, Sanchez F, Leosdottir M, Syv nen AC, Hamsten A, Melander
O, Bertorello AM. Influenze della chinasi 1 inducibili al sale
Attività Na (+), K (+) - ATPasi nelle cellule muscolari lisce vascolari
e si associa alle variazioni della pressione sanguigna. J Hypertens
2011; 29: 2395-2403 [PMID: 22045124 DOI: 10.1097/ HJH.0b01
3e32834d3d55]
70 Houston MC. Nutraceutici, vitamine, antiossidanti e
minerali nella prevenzione e nel trattamento dell'ipertensione.
Prog Cardiovasc Dis 2005; 47: 396-449 [PMID: 16115519 DOI:
10.1016 / j.pcad.2005.01.004]
71 Houston MC. Integratori nutrizionali e nutraceutici in
il trattamento dell'ipertensione. Esperto Rev Cardiovasc Ther
2010; 8: 821-833 [PMID: 20528640 DOI: 10.1586 / erc.10.63]
72 Messerli FH, Schmieder RE, Weir MR. Sale. Un autore di
malattia dell'organo target ipertensivo? Arch Intern Med 1997; 157:
2449-2452 [PMID: 9385295 DOI: 10.1001 / archinte.1997.00440
420077006]
73 Oliver WJ, Cohen EL, Neel JV. Pressione del sangue, assunzione di sodio,
e ormoni legati al sodio negli indiani Yanomamo,
una cultura «senza sale». Circolazione 1975; 52: 146-151 [PMID:
1132118 DOI: 10.1161 / 01.CIR.52.1.146]
74 Kawasaki T, Delea CS, Bartter FC, Smith H. L'effetto di
assunzione di sodio alto e basso contenuto di sodio sulla pressione sanguigna e
altre variabili correlate in soggetti umani con ipertensione idiopatica.
Am J Med 1978; 64: 193-198 [PMID: 629267 DOI:
10.1016/0002-9343(78)90045-1]
75 Toda N, Arakawa K. Regolazione emodinamica indotta dal sale
mediato dall'ossido nitrico. J Hypertens 2011; 29: 415-424 [PMID:
21150639 DOI: 10.1097/HJH.0b013e328341d19e]
76 Whelton PK, He J. Potassio nella prevenzione e nel trattamento
alta pressione sanguigna. Semin Nephrol 1999; 19: 494-499 [PMID:
10511389]
77 Gu D, He J, Wu X, Duan X, Whelton PK. Effetto di potassio
supplementazione sulla pressione sanguigna in cinese: un randomizzato,
prova controllata con placebo. J Hypertens 2001; 19: 1325-1331
[PMID: 11446724 DOI: 10.1097 / 00004872-200107000-00019]
78 He J, Gu D, Kelly TN, Hixson JE, Rao DC, Jaquish CE, Chen
J, Zhao Q, Gu C, Huang J, Shimmin LC, Chen JC, Mu J, Ji X,
Liu DP, Whelton PK. Varianti genetiche nel renina-angiotensina-aldosterone
sistema e le risposte della pressione sanguigna a
assunzione di potassio. J Hypertens 2011; 29: 1719-1730 [PMID:
21799445 DOI: 10.1097/HJH.0b013e32834a4d1f]
79 O Donnell MJ, Yusuf S, Mente A, Gao P, Mann JF, Teo K,
McQueen M, Sleight P, Sharma AM, Dans A, Probstfield J,
Schmieder RE. Escrezione urinaria di sodio e potassio e
rischio di eventi cardiovascolari. JAMA 2011; 306: 2229-2238
[PMID: 22110105 DOI: 10.1001 / jama.2011.1729]
80 Widman L, Wester PO, Stegmayr BK, Wirell M. Il dosedependent
riduzione della pressione sanguigna attraverso la somministrazione
di magnesio. Un crossover a doppio controllo placebo cieco
studia. Am J Hypertens 1993; 6: 41-45 [PMID: 8427660]
81 Laurant P, Touyz RM. Fisiologico e fisiopatologico
ruolo del magnesio nel sistema cardiovascolare: implicazioni
in ipertensione. J Hypertens 2000; 18: 1177-1191 [PMID:
10994748 DOI: 10.1097/00004872-200018090-00003]
82 Houston M. Il ruolo del magnesio nell'ipertensione e
malattia cardiovascolare. J Clin Hypertens (Greenwich) 2011;
13: 843-847 [PMID: 22051430 DOI: 10.1111/ j.1751-7176.2011.0
0538.x]
83 Rosanoff A, Weaver CM, Rude RK. Magnesio subottimale
stato negli Stati Uniti: le conseguenze sulla salute sono sottostimate?
Nutr Rev 2012; 70: 153-164 [PMID: 22364157
DOI: 10.1111 / j.1753-4887.2011.00465.x]
84 Song Y, Liu S. Magnesium per la salute cardiovascolare: tempo
per intervento Am J Clin Nutr 2012; 95: 269-270 [PMID:
22218155 DOI: 10.3945 / ajcn.111.031104]
85 Kupetsky-Rincon EA, Uitto J. Magnesio: nuove applicazioni
nella malattia cardiovascolare-una revisione della letteratura.
Ann Nutr Metab 2012; 61: 102-110 [PMID: 22907037 DOI:
10.1159 / 000339380]
86 Cunha AR, Umbelino B, Correia ML, Neves MF. Magnesio
e cambiamenti vascolari nell'ipertensione. Int J Hypertens 2012;
2012: 754250 [PMID: 22518291 DOI: 10.1155 / 2012 / 754250]
87 Kass L, Weekes J, Carpenter L. Effetto dell'integrazione di magnesio
sulla pressione sanguigna: una meta-analisi. Eur J Clin Nutr
2012; 66: 411-418 [PMID: 22318649 DOI: 10.1038 / ejcn.2012.4]
88 McCarron DA. Ruolo dell'assunzione adeguata di calcio nella dieta
la prevenzione e la gestione dell'ipertensione sensibile al sale.
Am J Clin Nutr 1997; 65: 712S-716S [PMID: 9022571]
89 Resnick LM. Metabolismo del calcio nell'ipertensione e alleato
disordini metabolici. Diabetes Care 1991; 14: 505-520 [PMID:
1864222 DOI: 10.2337 / diacare.14.6.505]
90 Garc a Zozaya JL, Padilla Viloria M. [Alterazioni del calcio,
magnesio e zinco nell'ipertensione essenziale: la loro relazione
al sistema renina-angiotensina-aldosterone]. Invest Clin
1997; 38 Suppl 2: 27-40 [PMID: 9471228]
91 Carpenter WE, Lam D, Toney GM, Weintraub NL, Qin Z.
Zinco, rame e pressione sanguigna: studi sulla popolazione umana.
Med Sci Monit 2013; 19: 1-8 [PMID: 23291705 DOI: 10.12659 /
MSM.883708]
92 Shahbaz AU, Sun Y, Bhattacharya SK, Ahokas RA, Gerling
IC, McGee JE, Weber KT. Fibrosi nella cardiopatia ipertensiva:
percorsi molecolari e strategie cardioprotettive. J
Hypertens 2010; 28 Suppl 1: S25-S32 [PMID: 20823713 DOI:
10.1097 / 01.hjh.0000388491.35836.d2]
93 Bergomi M, Rovesti S, Vinceti M, Vivoli R, Caselgrandi E,
Vivoli G. Zinco e stato del rame e pressione sanguigna. J Trace
Elem Med Biol 1997; 11: 166-169 [PMID: 9442464 DOI: 10.1016 /
S0946-672X(97)80047-8]
94 Stamler J, Elliott P, Kesteloot H, Nichols R, Claeys G, Dyer
AR, Stamler R. Relazione inversa dei marcatori proteici della dieta
con la pressione del sangue. Risultati per 10,020 uomini e donne in
lo studio INTERSALT. Ricerca cooperativa INTERSALT
Gruppo. Studio INTERNAZIONALE del SALE e della pressione sanguigna.
Circolazione 1996; 94: 1629-1634 [PMID: 8840854 DOI:
10.1161 / 01.CIR.94.7.1629]
95 Altorf-van der Kuil W, Engberink MF, Brink EJ, van Baak
MA, Bakker SJ, Navis G, van t Veer P, Geleijnse JM. dietetico
proteine e pressione sanguigna: una revisione sistematica. PLoS One
2010; 5: e12102 [PMID: 20711407 DOI: 10.1371 / journal.
pone.0012102]
96 Jenkins DJ, Kendall CW, Faulkner DA, Kemp T, Marchie
A, Nguyen TH, Wong JM, de Souza R, Emam A, Vidgen E,
Trautwein EA, Lapsley KG, Josse RG, Leiter LA, Cantante W.
Effetti a lungo termine di un portafoglio dietetico a base vegetale di abbassamento del colesterolo
alimenti sulla pressione sanguigna. Eur J Clin Nutr 2008;
62: 781-788 [PMID: 17457340 DOI: 10.1038 / sj.ejcn.1602768]
97 Elliott P, Dennis B, Dyer AR. Relazione delle proteine alimentari
(totale, vegetale, animale) alla pressione sanguigna: INTERMAP
studio epidemiologico Presentato al 18th Scientific Meeting
della International Society of Hypertension, Chicago, IL,
Agosto 20-24, 2000
98 Rebholz CM, Friedman EE, Powers LJ, Arroyave WD, He J,
Kelly TN. Assunzione di proteine e pressione sanguigna: una metaanalisi
di studi randomizzati e controllati. Am J Epidemiol 2012;
176 Suppl 7: S27-S43 [PMID: 23035142 DOI: 10.1093 / aje /
kws245]
99 Larsson SC, Virtamo J, Wolk A. Assunzione di proteine alimentari e rischio di ictus nelle donne. Aterosclerosi 2012; 224: 247-251 [PMID: 22854187]
100 He J, Wofford MR, Reynolds K, Chen J, Chen CS, Myers L,
Minori DL, Elmer PJ, Jones DW, Whelton PK. Effetto della dieta
supplementazione proteica sulla pressione sanguigna: un randomizzato,
prova controllata. Circolazione 2011; 124: 589-595 [PMID:
21768541 DOI: 10.1161 / CIRCULATIONAHA.110.009159]
101 Teunissen-Beekman KF, Dopheide J, Geleijnse JM, Bakker
SJ, Brink EJ, de Leeuw PW, van Baak MA. Integrazione proteica
abbassa la pressione sanguigna negli adulti sovrappeso: effetto
di proteine dietetiche sulla pressione sanguigna (PROPRES), un randomizzato
prova. Am J Clin Nutr 2012; 95: 966-971 [PMID: 22357725
DOI: 10.3945 / ajcn.111.029116]
102 FitzGerald RJ, Murray BA, Walsh DJ. Peptidi ipotensivi
dalle proteine del latte. J Nutr 2004; 134: 980S-988S [PMID:
15051858]
103 Pins JJ, Keenan JM. Effetti dei peptidi del siero su cardiovascolari
fattori di rischio di malattia. J Clin Hypertens (Greenwich) 2006; 8:
775-782 [PMID: 17086017 DOI: 10.1111/ j.1524-6175.2006.0566
7.x]
104 Aihara K, Kajimoto O, Hirata H, Takahashi R, Nakamura
Y. Effetto del latte fermentato in polvere con Lactobacillus
helveticus su soggetti con pressione sanguigna alta normale o
ipertensione lieve. J Am Coll Nutr 2005; 24: 257-265 [PMID:
16093403 DOI: 10.1080 / 07315724.2005.10719473]
105 Germino FW, Neutel J, Nonaka M, Hendler SS. L'impatto di
lattotripeptidi sulla risposta della pressione arteriosa nello stadio 1 e nello stadio
2 ipertensivi. J Clin Hypertens (Greenwich) 2010; 12: 153-159
[PMID: 20433527 DOI: 10.1111/ j.1751-7176.2009.00250.x]
106 Geleijnse JM, Engberink MF. Lattopeptidi e umani
pressione sanguigna. Curr Opin Lipidol 2010; 21: 58-63 [PMID:
19884823 DOI: 10.1097/MOL.0b013e3283333813]
107 Cicero AF, Aubin F, Azais-Braesco V, Borghi C. Fai il lattotripeptide
isoleucina-prolina-prolina e valina-prolinaprolina
ridurre la pressione sistolica nei soggetti europei?
Una meta-analisi di studi randomizzati e controllati. Am J Hypertens
2013; 26: 442-449 [PMID: 23382495 DOI: 10.1093 / ajh /
hps044]
108 Usinger L, Reimer C, Ibsen H. Latte fermentato per l'ipertensione.
Database Cochrane Syst Rev 2012; 4: CD008118 [PMID:
22513955 DOI: 10.1002/14651858.CD008118.pub2]
109 Ricci-Cabello I, Herrera MO, Artacho R. Possibile ruolo di
peptidi bioattivi derivati dal latte nel trattamento e nella prevenzione
della sindrome metabolica. Nutr Rev 2012; 70: 241-255
[PMID: 22458697 DOI: 10.1111 / j.1753-4887.2011.00448.x]
110 Jauhiainen T, Niittynen L, Orei? M, J rvenp S, Hiltunen
TP, R nnback M, Vapaatalo H, Korpela R. Effetti a lungo termine
assunzione di lattotripeptidi su fattori di rischio cardiovascolare
in soggetti ipertesi. Eur J Clin Nutr 2012; 66: 843-849
[PMID: 22617279 DOI: 10.1038 / ejcn.2012.44]
111 Pins JJ, Keenan JM. Gli effetti antipertensivi di un idrolizzato
integratore di proteine del siero del latte. Farmaci cardiovascolari
Ther 2002; 16: 68
112 Pal S, Radavelli-Bagatini S. Gli effetti delle proteine del siero di latte
sui fattori di rischio cardiometabolici. Obes Rev 2013; 14: 324-343
[PMID: 23167434 DOI: 10.1111 / obr.12005]
113 Zhu CF, Li GZ, Peng HB, Zhang F, Chen Y, Li Y. Terapeutico
effetti dei peptidi di collagene marino su pazienti cinesi
con tipo 2 diabete mellito e ipertensione primaria. am
J Med Sci 2010; 340: 360-366 [PMID: 20739874 DOI: 10.1097 /
MAJ.0b013e3181edfcf2]
114 De Leo F, Panarese S, Gallerani R, Ceci LR. Conversione dell'angiotensina
peptidi inibitori enzimatici (ACE): produzione e
implementazione di cibo funzionale. Curr Pharm Des 2009; 15:
3622-3643 [PMID: 19925416 DOI: 10.2174 / 138161209789271834]
115 Lordan S, Ross RP, Stanton C. I bioattivi marini sono funzionali
ingredienti alimentari: potenziale per ridurre l'incidenza
di malattie croniche. Mar Drugs 2011; 9: 1056-1100 [PMID:
21747748 DOI: 10.3390 / md9061056]
116 Fujita H, Yoshikawa M. LKPNM: un ACEinhibitory di tipo profarmaco
peptide derivato da proteine del pesce. immunofarmacologia
1999; 44: 123-127 [PMID: 10604535 DOI: 10.1016/ S0162
-3109 (99) 00118-6]
117 Kawasaki T, Seki E, Osajima K, Yoshida M, Asada K, Matsui
T, Osajima Y. Effetto antiipertensivo della valil-tirosina, a
peptide a catena corta derivato dall'idrolizzato di muscoli della sardina,
su soggetti ipertesi lievi. J Hum Hypertens 2000;
14: 519-523 [PMID: 10962520 DOI: 10.1038 / sj.jhh.1001065]
118 Kawasaki T, Jun CJ, Fukushima Y, Kegai K, Seki E, Osajima
K, Itoh K, Matsui T, Matsumoto K. [Effetto antipertensivo
e valutazione della sicurezza della bevanda vegetale con peptidi
derivato da idrolizzati di proteine della sardina su ipertensione lieve,
soggetti con pressione arteriosa normale e alta normale].
Fukuoka Igaku Zasshi 2002; 93: 208-218 [PMID: 12471719]
119 Yang G, Shu XO, Jin F, Zhang X, Li HL, Li Q, Gao YT, Zheng
W. Studio longitudinale sull'assunzione di cibo a base di soia e pressione sanguigna
tra donne cinesi di mezza età e anziane. Am J
Clin Nutr 2005; 81: 1012-1017 [PMID: 15883423]
120 Dong JY, Tong X, Wu ZW, Xun PC, He K, Qin LQ. Effetto
di proteine di soia sulla pressione sanguigna: una meta-analisi di randomizzati
prove controllate. Br J Nutr 2011; 106: 317-326 [PMID:
21342608 DOI: 10.1017 / S0007114511000262]
121 Teede HJ, Giannopoulos D, Dalais FS, Hodgson J, McGrath
BP. Studio randomizzato, controllato, cross-over di proteine di soia
con isoflavoni sulla pressione arteriosa e funzione arteriosa in
soggetti ipertesi. J Am Coll Nutr 2006; 25: 533-540 [PMID:
17229901 DOI: 10.1080 / 07315724.2006.10719569]
122 Welty FK, Lee KS, Lew NS, Zhou JR. Effetto di noci di soia su
pressione sanguigna e livelli lipidici in ipertensiva, preipertensiva,
e normotesi donne in postmenopausa. Arco
Stagista Med 2007; 167: 1060-1067 [PMID: 17533209 DOI:
10.1001 / archinte.167.10.1060]
123 Rosero Arenas MA, Rosero Arenas E, Portaceli Armi ana
MA, Garc a Garc a MA. [Utilità dei fitoestrogeni in
riduzione della pressione sanguigna. Revisione sistematica e metaanalisi).
Aten Primaria 2008; 40: 177-186 [PMID: 18405582]
124 Nasca MM, Zhou JR, Welty FK. Effetto delle noci di soia sull'adesione
molecole e marcatori di infiammazione in ipertesi
e normotesi donne in postmenopausa. am
J Cardiol 2008; 102: 84-86 [PMID: 18572041 DOI: 10.1016 /
j.amjcard.2008.02.100]
125 He J, Gu D, Wu X, Chen J, Duan X, Chen J, Whelton PK.
Effetto della proteina di soia sulla pressione sanguigna: un randomizzato,
prova controllata. Ann Intern Med 2005; 143: 1-9 [PMID:
15998749 DOI: 10.7326/0003-4819-143-1-200507050-00004]
126 Hasler CM, Kundrat S, Lana D. Alimenti funzionali e cardiovascolari
malattia. Curr Atheroscler Rep 2000; 2: 467-475
[PMID: 11122780 DOI: 10.1007 / s11883-000-0045-9]
127 Tikkanen MJ, Adlercreutz H. Isoflavone dietetico a base di soia
fitoestrogeni. Potrebbero avere un ruolo nella coronaria
prevenzione delle malattie cardiache? Biochem Pharmacol 2000; 60: 1-5
[PMID: 10807939]
128 Begg DP, Sinclair AJ, Stahl LA, Garg ML, Jois M, Weisinger
RS. Il livello proteico della dieta interagisce con i polinsaturi omega-3
carenza di acidi grassi per indurre l'ipertensione. Am J
Hypertens 2010; 23: 125-128 [PMID: 19893499 DOI: 10.1038 /
ajh.2009.198]
129 Vallance P, Leone A, Calibro A, Collier J, Moncada S. Endogenous
dimetilarginina come inibitore dell'ossido nitrico
sintesi. J Cardiovasc Pharmacol 1992; 20 Suppl 12: S60-S62
[PMID: 1282988 DOI: 10.1097 / 00005344-199204002-00018]
130 Sonmez A, Celebi G, Erdem G, Tapan S, Genc H, Tasci I,
Ercin CN, Dogru T, Kilic S, Uckaya G, Yilmaz MI, Erbil MK,
Kutlu M. Plasma apelin e livelli di ADMA in pazienti con
ipertensione essenziale. Clin Exp Hypertens 2010; 32: 179-183
[PMID: 20504125 DOI: 10.3109 / 10641960903254505]
131 Michell DL, Andrews KL, Chin-Dusting JP. endothelial
disfunzione nell'ipertensione: il ruolo dell'arginasi. Front Biosci
(Schol Ed) 2011; 3: 946-960 [PMID: 21622244]
132 Rajapakse NW, Mattson DL. Ruolo della L-arginina nell'ossido nitrico
produzione in salute e ipertensione. Clin Exp Pharmacol
Physiol 2009; 36: 249-255 [PMID: 19076168 DOI: 10.1111 / j.1440-1681.2008.05123.x]
133 Tsioufis C, Dimitriadis K, Andrikou E, Thomopoulos C,
Tsiachris D, Stefanadi E, Mihas C, Miliou A, Papademetriou
V, Stefanadis C. ADMA, proteina C-reattiva e albuminuria
in ipertensione essenziale non trattata: uno studio trasversale.
Am J Kidney Dis 2010; 55: 1050-1059 [PMID: 20189274 DOI:
10.1053 / j.ajkd.2009.11.024]
134 Rajapakse NW, Mattson DL. Ruolo della L-arginina cellulare
captazione e produzione di ossido nitrico sul flusso ematico renale e
regolazione della pressione arteriosa. Curr Opin Nephrol Hypertens
2013; 22: 45-50 [PMID: 23095292 DOI: 10.1097/ MNH.0b013e
32835a6ff7]
135 Ruiz-Hurtado G, Delgado C. Via dell'ossido nitrico in ipertrofico
cuore: nuovi usi terapeutici dei donatori di ossido d'azoto.
J Hypertens 2010; 28 Suppl 1: S56-S61 [PMID: 20823718 DOI:
10.1097 / 01.hjh.0000388496.66330.b8]
136 Siani A, Pagano E, Iacone R, Iacoviello L, Scopacasa F, Strazzullo
P. Pressione sanguigna e cambiamenti metabolici durante la dieta
Integrazione di L-arginina nell'uomo. Am J Hypertens
2000; 13: 547-551 [PMID: 10826408 DOI: 10.1016/ S0895-7061(
99) 00233-2]
137 Facchinetti F, Saade GR, Neri I, Pizzi C, Longo M, Volpe
A. Integrazione di L-arginina in pazienti con gestazione
ipertensione: uno studio pilota. Ipertens gravidanza 2007; 26:
121-130 [PMID: 17454224 DOI: 10.1080 / 10641950601147994]
138 Neri I, Monari F, Sgarbi L, Berardi A, Masellis G, Facchinetti
Supplemento di F. L-arginina nelle donne con ipertensione cronica:
impatto sulla pressione sanguigna e materna e neonatale
complicazioni. J Matern Fetal Neonatal Med 2010; 23: 1456-1460
[PMID: 20958228 DOI: 10.3109 / 14767051003677962]
139 Martina V, Masha A, Gigliardi VR, Brocato L, Manzato E,
Berchio A, Massarenti P, Settanni F, Della Casa L, Bergamini
S, Iannone A. N-acetilcisteina a lungo termine e L-arginina
la somministrazione riduce l'attivazione endoteliale e la sistolica
pressione arteriosa in pazienti ipertesi con diabete tipo 2.
Diabetes Care 2008; 31: 940-944 [PMID: 18268065 DOI:
10.2337 / dc07-2251]
140 Ast J, Jablecka A, Bogdanski P, Smolarek I, Krauss H, Chmara
E. Valutazione dell'effetto antiipertensivo della L-arginina
supplementazione in pazienti con ipertensione lieve valutata
con monitoraggio ambulatoriale della pressione arteriosa. Med Sci
Monit 2010; 16: CR266-CR271 [PMID: 20424555]
141 Dong JY, Qin LQ, Zhang Z, Zhao Y, Wang J, Arigoni F,
Zhang W. Effetto della supplementazione orale di L-arginina su
pressione sanguigna: una meta-analisi di randomizzato, doppio cieco,
studi controllati con placebo. Am Heart J 2011; 162: 959-965
[PMID: 22137067 DOI: 10.1016 / j.ahj.2011.09.012]
142 Miller GD, Marsh AP, Dove RW, Beavers D, Presley T,
Helms C, Bechtold E, King SB, Kim-Shapiro D. Nitrato di plasma
e il nitrito è aumentato da un supplemento ad alto nitrato ma
non dagli alimenti ad alto contenuto di nitrati negli anziani. Nutr Res 2012; 32:
160-168 [PMID: 22464802 DOI: 10.1016 / j.nutres.2012.02.002]
143 Schulman SP, Becker LC, Kass DA, Champion HC, Terrin
ML, Forman S, Ernst KV, Kelemen MD, Townsend SN,
Terapia Capriotti A, Hare JM, Gerstenblith G. L-arginina in
infarto miocardico acuto: l'interazione vascolare con
Età in infarto miocardico (VINTAGE MI) randomizzata
test clinico. JAMA 2006; 295: 58-64 [PMID: 16391217 DOI:
10.1001 / jama.295.1.58]
144 Miguel-Carrasco JL, Monserrat MT, Mate A, VÃzquez CM.
Effetti comparativi di captopril e l-carnitina sul sangue
espressione del gene dell'enzima di pressione e antiossidante nel cuore
di ratti spontaneamente ipertesi. Eur J Pharmacol 2010; 632:
65-72 [PMID: 20123095 DOI: 10.1016/ j.ejphar.2010.01.017]
145 Zambrano S, Blanca AJ, Ruiz-Armenta MV, Miguel-Carrasco
JL, Ar valo M, V zquez MJ, Mate A, V zquez CM. L-Carnitina
protegge contro il cuore arterioso ipertensivo
fibrosi attraverso la modulazione di PPAR-? espressione. biochimica
Pharmacol 2013; 85: 937-944 [PMID: 23295156 DOI: 10.1016 /
j.bcp.2012.12.021]
146 Vilskersts R, Kuka J, Svalbe B, Cirule H, Liepinsh E, Grinberga
S, Kalvinsh I, Dambrova M. Amministrazione della L-carnitina
e il mildronate migliora la funzione endoteliale e
diminuisce la mortalità nei ratti Dahl ipertesi. Pharmacol Rep
2011; 63: 752-762 [PMID: 21857086]
147 Mate A, Miguel-Carrasco JL, Monserrat MT, Vzquez CM.
Proprietà antiossidanti sistemiche della L-carnitina in due differenti
modelli di ipertensione arteriosa. J Physiol Biochem 2010; 66:
127-136 [PMID: 20506010 DOI: 10.1007 / s13105-010-0017-7]
148 Digiesi V, Cantini F, Bisi G, Guarino G, Brodbeck B. L-carnitina
terapia adiuvante nell'ipertensione essenziale. Clin Ter
1994; 144: 391-395 [PMID: 7924177]
149 Ghidini O, Azzurro M, Vita G, Sartori G. Valutazione del
efficacia terapeutica della L-carnitina nell'insufficienza cardiaca congestizia.
Int J Clin Pharmacol Ther Toxicol 1988; 26: 217-220 [PMID:
3403101]
150 Digiesi V, Palchetti R, Cantini F. [I benefici della L-carnitina
terapia nell'ipertensione arteriosa essenziale con diabete mellito
tipo II]. Minerva Med 1989; 80: 227-231 [PMID: 2654758]
151 Ruggenenti P, Cattaneo D, Loriga G, Ledda F, Motterlini N,
Gherardi G, Orisio S, Remuzzi G. Miglioramento dell'ipertensione
e resistenza all'insulina nei soggetti ad aumentato rischio cardiovascolare
rischio: effetti della terapia con acetil-L-carnitina. Ipertensione 2009;
54: 567-574 [PMID: 19620516]
152 Mate A, Miguel-Carrasco JL, Vózquez CM. Il terapeutico
prospettive di utilizzo della L-carnitina per gestire ipertensione
danno d'organo. Drug Discov Today 2010; 15: 484-492 [PMID:
20363359 DOI: 10.1016 / j.drudis.2010.03.014]
153 Korkmaz S, Y?ld?z G, K?l? l? F, Y?lmaz A, Ayd?n H, I a?as?o?lu
S, Candan F. [Livelli di L-carnitina bassa: può essere una causa di
alterazioni della pressione sanguigna notturna nei pazienti con diabete di tipo 2
mellito?]. Anadolu Kardiyol Derg 2011; 11: 57-63 [PMID:
21220248 DOI: 10.5152 / akd.2011.008]
154 Huxtable RJ. Azioni fisiologiche della taurina. Physiol Rev
1992; 72: 101-163 [PMID: 1731369]
155 Fujita T, Ando K, Noda H, Ito Y, Sato Y. Effetti di aumento
attività adrenomedullary e taurina in pazienti giovani con
ipertensione borderline. Circolazione 1987; 75: 525-532 [PMID:
3815764 DOI: 10.1161 / 01.CIR.75.3.525]
156 Huxtable RJ, Sebring LA. Azioni cardiovascolari di taurina.
Prog Clin Biol Res 1983; 125: 5-37 [PMID: 6348796]
157 Feng Y, Li J, Yang J, Yang Q, Lv Q, Gao Y, Hu J. Sinergico
effetti di taurina e L-arginina sull'attenuazione dell'insulino-resistenza
ipertensione. Adv Exp Med Biol 2013; 775: 427-435
[PMID: 23392951 DOI: 10.1007/978-1-4614-6130-2_32]
158 W jcik OP, Koenig KL, Zeleniuch-Jacquotte A, Pearte C,
Costa M, Chen Y. Siero taurino e rischio di cuore coronarico
malattia: uno studio caso-controllo prospettico, annidato. Eur J Nutr
2013; 52: 169-178 [PMID: 22322924 DOI: 10.1007/ s00394-011-
0300-6]
159 Abebe W, Mozaffari MS. Ruolo della taurina nella vascolarizzazione:
una panoramica degli studi sperimentali e umani. Am J Cardiovasc
Dis 2011; 1: 293-311 [PMID: 22254206]
160 Yamori Y, Taguchi T, Hamada A, Kunimasa K, Mori H, Mori
M. Taurina in salute e malattie: prove coerenti da
studi sperimentali ed epidemiologici. J Biomed Sci 2010; 17
Suppl 1: S6 [PMID: 20804626 DOI: 10.1186 / 1423-0127-17-S1-S6]
161 Yamori Y, Taguchi T, Mori H, Mori M. Basso cardiovascolare
rischi nei maschi e nelle femmine di mezza età che escono più grandi
24-hour taurina urinaria e magnesio in 41 WHO-CARDIAC
studiare popolazioni nel mondo. J Biomed Sci 2010; 17 Suppl
1: S21 [PMID: 20804596 DOI: 10.1186 / 1423-0127-17-S1-S21]
162 Tanabe Y, Urata H, Kiyonaga A, Ikeda M, Tanaka H, Shindo
M, Arakawa K. Variazioni delle concentrazioni sieriche di taurina
e altri amminoacidi nell'esercizio clinico antiipertensivo
terapia. Clin Exp Hypertens A 1989; 11: 149-165 [PMID:
2565773]
163 Mori TA, Bao DQ, Burke V, Puddey IB, Beilin LJ. docosaesaenoico
acido ma non acido eicosapentaenoico abbassa ambulatorio
pressione sanguigna e battito cardiaco nell'uomo. Ipertensione
1999; 34: 253-260 [PMID: 10454450 DOI: 10.1161 / 01.
HYP.34.2.253]
164 B naa KH, Bjerve KS, Straume B, Gram IT, Thelle D. Effect
di acidi eicosapentaenoico e docosaesaenoico sul sangue
pressione nell'ipertensione. Un intervento basato sulla popolazione
prova dallo studio di Troms. N inglese J Med 1990; 322: 795-801
[PMID: 2137901 DOI: 10.1056 / NEJM199003223221202]
165 Mori TA, Burke V, Puddey I, irlandese A, Cowpland CA, Beilin
L, Dogra G, Watts GF. Gli effetti degli acidi grassi [omega] 3
e coenzima Q10 sulla pressione sanguigna e sulla frequenza cardiaca in
malattia renale cronica: uno studio controllato randomizzato. J Hypertens
2009; 27: 1863-1872 [PMID: 19705518 DOI: 10.1097 /
HJH.0b013e32832e1bd9]
166 Ueshima H, Stamler J, Elliott P, Chan Q, Brown IJ, Carnethon
MR, Daviglus ML, He K, Moag-Stahlberg A, Rodriguez
BL, Steffen LM, Van Horn L, Yarnell J, Zhou B. Cibo
assunzione di acidi grassi omega-3 di individui (totale, acido linolenico,
lunga catena) e la loro pressione sanguigna: studio INTERMAP. Ipertensione
2007; 50: 313-319 [PMID: 17548718]
167 Mori TA. Omega-3 acidi grassi e ipertensione nell'uomo.
Clin Exp Pharmacol Physiol 2006; 33: 842-846 [PMID: 16922818
DOI: 10.1111 / j.1440-1681.2006.04451.x]
168 Noreen EE, Brandauer J. Gli effetti del pesce supplementare
olio su pressione sanguigna e cortisolo mattutino in normotesi
adulti: uno studio pilota. J Complement Integr Med 2012; 9:
1553-3840 [PMID: 23104856 DOI: 10.1515 / 1553-3840.1467]
169 Bhise A, Krishnan PV, Aggarwal R, Gaiha M, Bhattacharjee
J. Effetto della sostituzione degli acidi grassi omega-3 a basse dosi
su pressione sanguigna, iperinsulinemia e dislipidemia in
Indiani con ipertensione essenziale: uno studio pilota. J indiano
Clin Biochem 2005; 20: 4-9 [PMID: 23105526 DOI: 10.1007 /
BF02867393]
170 Cabo J, Alonso R, Mata P. Omega-3 acidi grassi e sangue
pressione. Br J Nutr 2012; 107 Suppl 2: S195-S200 [PMID:
22591893 DOI: 10.1017 / S0007114512001584]
171 Huang T, Shou T, Cai N, Wahlqvist ML, Li D. Associazioni
di acidi grassi polinsaturi n-3 al plasma con pressione sanguigna
e fattori di rischio cardiovascolare tra i cinesi. Int J
Food Sci Nutr 2012; 63: 667-673 [PMID: 22263527 DOI: 10.310
9 / 09637486.2011.652076]
172 Sagara M, Njelekela M, Teramoto T, Taguchi T, Mori M,
Armitage L, Birt N, Birt C, Yamori Y. Effetti di docosaesaenoica
Supplemento acido sulla pressione sanguigna, frequenza cardiaca,
e lipidi sierici negli uomini scozzesi con ipertensione e ipercolesterolemia.
Int J Hypertens 2011; 2011: 809198 [PMID:
21423683 DOI: 10.4061 / 2011 / 809198]
173 Passfall J, Philipp T, Woermann F, Quass P, Thiede M,
Haller H. Diversi effetti dell'acido eicosapentaenoico e dell'olivo
olio sulla pressione sanguigna, calcio piastrinico libero intracellulare e
lipidi plasmatici in pazienti con ipertensione essenziale. clin
Investig 1993; 71: 628-633 [PMID: 8219660]
174 Liu JC, Conklin SM, Manuck SB, Yao JK, Muldoon MF.
Acidi grassi omega-3 a catena lunga e pressione sanguigna. Am J
Hypertens 2011; 24: 1121-1126 [PMID: 21753804 DOI: 10.1038 /
ajh.2011.120]
175 Engler MM, Schambelan M, Engler MB, Ball DL, Goodfriend
TL. Effetti dell'acido gamma-linolenico sulla pressione sanguigna
e recettori surrenali dell'angiotensina nei ratti ipertesi.
Proc Soc Exp Biol Med 1998; 218: 234-237 [PMID: 9648942]
176 Chin JP. Oli marini e reattività cardiovascolare. Le prostaglandine
Acidi grassi Essent di Leukot 1994; 50: 211-222 [PMID:
8066094 DOI: 10.1016/0952-3278(94)90156-2]
177 Saravanan P, Davidson NC, Schmidt EB, Calder PC. Cardiovascolare
effetti degli acidi grassi marini omega-3. Lancetta
2010; 376: 540-550 [PMID: 20638121 DOI: 10.1016 / S0140-
6736 (10) 60445-X]
178 Ferrara LA, Raimondi AS, d Episcopo L, Guida L, Dello
Russo A, Marotta T. Olio d'oliva e ridotta necessità di antipertensivi
farmaci. Arch Intern Med 2000; 160: 837-842
[PMID: 10737284 DOI: 10.1001 / archinte.160.6.837]
179 Alonso A, Ruiz-Gutierrez V, Mart nez-Gonz lez MA. monoinsaturi
acidi grassi, olio d'oliva e pressione sanguigna: epidemiologica,
evidenza clinica e sperimentale. Salute pubblica
Nutr 2006; 9: 251-257 [PMID: 16571180]
180 Ter s S, Barcel -Coblijn G, Benet M, Alvarez R, Bressani R,
Halver JE, Escrib PV. Il contenuto di acido oleico è responsabile di
la riduzione della pressione sanguigna indotta dall'olio d'oliva. proc
Natl Acad Sci USA 2008; 105: 13811-13816 [PMID: 18772370
DOI: 10.1073 / pnas.0807500105]
181 Cherif S, Rahal N, Haouala M, Hizaoui B, Dargouth F,
Gueddiche M, Kallel Z, Balansard G, Boukef K. [Un clinico
prova di un estratto di Olea titolato nel trattamento di essenziale
ipertensione arteriosa]. J Pharm Belg 1996; 51: 69-71 [PMID:
8786521]
182 Psaltopoulou T, Naska A, Orfanos P, Trichopoulos D,
Mountokalakis T, Trichopoulou A. Olio d'oliva, il Mediterraneo
dieta e pressione arteriosa: l'europeo greco
Indagine prospettica su cancro e nutrizione (EPIC)
studia. Am J Clin Nutr 2004; 80: 1012-1018 [PMID: 15447913]
183 Alonso A, Martínez-González MA. Consumo di olio d'oliva
e ridotta incidenza di ipertensione: lo studio SUN. lipidi
2004; 39: 1233-1238 [PMID: 15736920 DOI: 10.1007/ s11745
-004-1352-x]
184 Perrinjaquet-Moccetti T, Busjahn A, Schmidlin C, Schmidt
A, Bradl B, Aydogan C. Integratore alimentare con un'oliva
(Olea europaea L.) estratto di foglie riduce la pressione sanguigna in borderline
gemelli monozigoti ipertesi. Phytother Res 2008;
22: 1239-1242 [PMID: 18729245 DOI: 10.1002 / ptr.2455]
185 Moreno-Luna R, Mu oz-Hernandez R, Miranda ML, Costa
AF, Jimenez-Jimenez L, Vallejo-Vaz AJ, Muriana FJ, Villar J,
Stiefel P. I polifenoli dell'olio d'oliva riducono la pressione sanguigna e
migliorare la funzione endoteliale nelle giovani donne con lieve
ipertensione. Am J Hypertens 2012; 25: 1299-1304 [PMID:
22914255 DOI: 10.1038 / ajh.2012.128]
186 Thomsen C, Rasmussen OW, Hansen KW, Vesterlund M,
Hermansen K. Confronto degli effetti sul diurno
livelli di pressione sanguigna, glucosio e lipidi di una dieta ricca di
acidi grassi monoinsaturi con una dieta ricca di polinsaturi
acidi grassi nei soggetti diabetici tipo 2. Diabet Med 1995;
12: 600-606 [PMID: 7554782 DOI: 10.1111 / j.1464-5491.1995.
tb00549.x]
187 Perona JS, Ca izares J, Montero E, S nchez-Dom nguez JM,
Catal A, Ruiz-Guti rrez V. L'olio d'oliva vergine riduce il sangue
pressione nei soggetti anziani ipertesi. Clin Nutr 2004; 23:
1113-1121 [PMID: 15380903 DOI: 10.1016 / j.clnu.2004.02.004]
188 Perona JS, Montero E, S nchez-Dom nguez JM, Ca izares
J, Garcia M, Ruiz-Guti rrez V. Valutazione dell'effetto di
olio d'oliva vergine dietetico sulla pressione sanguigna e composizione lipidica
di siero e lipoproteine a bassa densità nel tipo anziano
Soggetti diabetici 2. J Agric Food Chem 2009; 57: 11427-11433
[PMID: 19902947 DOI: 10.1021 / jf902321x]
189 Susalit E, Agus N, Effendi I, Tjandrawinata RR, Nofiarny
D, Perrinjaquet-Moccetti T, Verbruggen M. Olive (Olea europaea)
estratto di foglie efficace nei pazienti con ipertensione allo stadio 1:
confronto con Captopril. Fitomedicina 2011; 18:
251-258 [PMID: 21036583 DOI: 10.1016/ j.phymed.2010.08.016]
190 L pez-Miranda J, P rez-Jim nez F, Ros E, De Caterina R,
Badimón L, Covas MI, Escrich E, Ordov s JM, Soriguer F,
Abi R, de la Lastra CA, Battino M, Corella D, ChamorroQuir s
J, Delgado-Lista J, Giugliano D, Esposito K, Estruch
R, Fernandez-Real JM, Gaforio JJ, La Vecchia C, Lairon D,
L pez-Segura F, Mata P, Men ndez JA, Muriana FJ, Osada
J, Panagiotakos DB, Paniagua JA, P rez-Martinez P, Perona
J, Peinado MA, Pineda-Priego M, Poulsen HE, Quiles JL,
Ram rez-Tortosa MC, Ruano J, Serra-Majem L, Sol R, Solanas
M, Solfrizzi V, della Torre-Fornell R, Trichopoulou
A, Uceda M, Villalba-Montoro JM, Villar-Ortiz JR, Visioli
F, Yiannakouris N. Olio d'oliva e salute: sintesi del II
conferenza internazionale sull'olio d'oliva e il consenso alla salute
report, Ja n e C rdoba (Spagna) 2008. Nutr Metab Cardiovasc
Dis 2010; 20: 284-294 [PMID: 20303720 DOI: 10.1016 /
j.numecd.2009.12.007]
191 Zhang J, Villacorta L, Chang L, Fan Z, Hamblin M, Zhu T,
Chen CS, Cole MP, Schopfer FJ, Deng CX, Garcia-Barrio MT, Feng YH, Freeman BA, Chen YE. L'acido nitro-oleico inibisce l'ipertensione indotta dall'angiotensina II. Circ Ris 2010; 107: 540-548 [PMID: 20558825 DOI: 10.1161/CIRCRESAHA.110.218404]
192 Scheffler A, Rauwald HW, Kampa B, Mann U, Mohr FW,
L'estratto di foglie di Dhein S. Olea europaea esercita L-tipo Ca (2 +)
incanalare gli effetti antagonistici. J Ethnopharmacol 2008; 120:
233-240 [PMID: 18790040 DOI: 10.1016 / j.jep.2008.08.018]
193 Papamichael CM, Karatzi KN, Papaioannou TG, Karatzis
EN, Katsichti P, Sideris V, Zakopoulos N, Zampelas A,
Lekakis JP. Effetti combinati acuti di olio d'oliva e vino
riflessioni delle onde di pressione: un'altra influenza benefica di
la dieta mediterranea antiossidanti? J Hypertens 2008; 26:
223-229 [PMID: 18192835 DOI: 10.1097/ HJH.0b013e3282f25b
80]
194 He J, Whelton PK. Effetto della fibra alimentare e assunzione di proteine
sulla pressione sanguigna: una revisione delle prove epidemiologiche. clin
Exp Hypertens 1999; 21: 785-796 [PMID: 10423101 DOI: 10.310
9 / 10641969909061008]
195 Pruijm M, Wuerzer G, Forni V, Bochud M, Pechère-Bertschi
A, Burnier M. [Nutrizione e ipertensione: più che tavolo
sale]. Rev Med Suisse 2010; 6: 1715-1716, 1718-1720, [PMID:
21294306]
196 Sherman DL, Keaney JF, Biegelsen ES, Duffy SJ, Coffman
JD, Vita JA. Concentrazioni farmacologiche di acido ascorbico
sono necessari per l'effetto benefico sul vasomotore endoteliale
funzione nell'ipertensione. Ipertensione 2000; 35: 936-941
[PMID: 10775565]
197 Ness AR, Khaw KT, Bingham S, Day NE. Stato della vitamina C.
e pressione sanguigna. J Hypertens 1996; 14: 503-508 [PMID:
8761901]
198 Duffy SJ, Gokce N, Holbrook M, Huang A, Frei B, Keaney
JF, Vita JA. Trattamento dell'ipertensione con acido ascorbico.
Lancet 1999; 354: 2048-2049 [PMID: 10636373 DOI: 10.1016 /
S0140-6736(99)04410-4]
199 Enstrom JE, Kanim LE, Klein MA. Assunzione di vitamina C e
mortalità tra un campione della popolazione degli Stati Uniti.
Epidemiologia 1992; 3: 194-202 [PMID: 1591317 DOI: 10.1097 / 0
0001648-199205000-00003]
200 Block G, Jensen CD, Norkus EP, Hudes M, Crawford PB. Vitamina
C nel plasma è inversamente correlato alla pressione sanguigna e
cambiamento della pressione sanguigna durante l'anno precedente in giovane età
Donne in bianco e nero Nutr J 2008; 7: 35 [PMID: 19091068
DOI: 10.1186/1475-2891-7-35]
201 Hatzitolios A, Iliadis F, Katsiki N, Baltatzi M. È l'antiipertensivo
effetto degli integratori alimentari tramite aldeidi
evidenza di riduzione basata? Una revisione sistematica. Clin Exp
Hypertens 2008; 30: 628-639 [PMID: 18855266 DOI: 10.1080 / 1
0641960802443274]
202 Mahajan AS, Babbar R, Kansal N, Agarwal SK, Ray PC. antiipertensivo
e azione antiossidante di amlodipina e vitamina
C in pazienti con ipertensione essenziale. J Clin Biochem Nutr
2007; 40: 141-147 [PMID: 18188416 DOI: 10.3164/ jcbn.40.141]
203 Leclerc PC, Proulx CD, Arguin G, B langer S, Gobeil F, Escher
E, Leduc R, Guillemette G. L'acido ascorbico diminuisce il legame
affinità del recettore AT1 per l'angiotensina II. Am J Hypertens
2008; 21: 67-71 [PMID: 18091746 DOI: 10.1038/ ajh.2007.1]
204 Plantinga Y, Ghiadoni L, Magagna A, Giannarelli C, Franzoni
F, Taddei S, Salvetti A. Integrazione con vitamine
C ed E migliora la rigidità arteriosa e l'endoteliale
funzione in pazienti ipertesi essenziali. Am J Hypertens
2007; 20: 392-397 [PMID: 17386345 DOI: 10.1016/ j.amjhyper.2006.09.021]
205 Sato K, Dohi Y, Kojima M, Miyagawa K, Takase H, Katada
E, Suzuki S. Effetti dell'acido ascorbico sul sangue ambulatorio
pressione nei pazienti anziani con ipertensione refrattaria.
Arzneimittelforschung 2006; 56: 535-540 [PMID: 16927536]
206 Block G, Mangels AR, Norkus EP, Patterson BH, Levander
OA, Taylor PR. Stato dell'acido ascorbico e successiva diastolica
e pressione sanguigna sistolica. Ipertensione 2001; 37: 261-267
[PMID: 11230282 DOI: 10.1161 / 01.HYP.37.2.261]
207 McRae MP. La vitamina C è un integratore antipertensivo efficace?
Una revisione e analisi della letteratura. J Chiropr
Med 2006; 5: 60-64 [PMID: 19674673 DOI: 10.1016/ S0899-346
7 (07) 60134-7]
208 Simon JA. Vitamina C e malattie cardiovascolari: una revisione. J
Am Coll Nutr 1992; 11: 107-125 [PMID: 1578086]
209 Ness AR, Chee D, Elliott P. Vitamina C e pressione sanguigna-an
Panoramica. J Hum Hypertens 1997; 11: 343-350 [PMID:
9249227 DOI: 10.1038 / sj.jhh.1000423]
210 Trout DL. Vitamina C e fattori di rischio cardiovascolare. Am J
Clin Nutr 1991; 53: 322S-325S [PMID: 1985405]
211 Fulwood R, Johnson CL, Bryner JD; Centro nazionale per
Statistiche sanitarie. Biochimica ematologica e nutrizionale
Dati di riferimento per le persone 6 Mesi-74 Anni di età:
Stati Uniti, 1976-1980. Washington DC; Salute pubblica degli Stati Uniti
Servizio; 1982 serie di statistiche sulla salute e la salute 11, n. 232,
Pubblicazione DHHS numero (PHS) 83-1682
212 Ward NC, Wu JH, Clarke MW, Puddey IB, Burke V, Croft
KD, Hodgson JM. L'effetto della vitamina E sulla pressione sanguigna
in soggetti con diabete di tipo 2: un doppio cieco randomizzato
prova controllata con placebo. J Hypertens 2007; 25: 227-234
[PMID: 17143195]
213 Murray ED, Wechter WJ, Kantoci D, Wang WH, Pham T,
Disputa DD, Gibson KM, Leipold D, Anner BM. Endogeno
fattori natriuretici 7: biospecificity di un gammatocopherol natriuretico
metabolita LLU-alfa. J Pharmacol Exp Ther 1997;
282: 657-662 [PMID: 9262327]
214 Grey B, Swick J, Ronnenberg AG. Vitamina E e adiponectina:
meccanismo proposto per il miglioramento indotto da vitamina E
nella sensibilità all'insulina. Nutr Rev 2011; 69: 155-161 [PMID:
21348879 DOI: 10.1111 / j.1753-4887.2011.00377.x]
215 Lind L, H nni A, Lithell H, Hvarfner A, S rensen OH,
La vitamina D di Ljunghall è correlata alla pressione sanguigna e ad altri
fattori di rischio cardiovascolare negli uomini di mezza età. Am J Hypertens
1995; 8: 894-901 [PMID: 8541004 DOI: 10.1016 / 0895-7061
(95) 00154-H]
216 Bednarski R, Donderski R, Manitius J. [Ruolo della vitamina D3
nel controllo della pressione arteriosa]. Pol Merkur Lekarski 2007;
23: 307-310 [PMID: 18293857]
217 Ngo DT, Sverdlov AL, McNeil JJ, Horowitz JD. La vitamina
D modulare la dimetilarginina asimmetrica e la C-reattiva
concentrazioni di proteine? Am J Med 2010; 123: 335-341 [PMID:
20362753 DOI: 10.1016 / j.amjmed.2009.09.024]
218 Rosen CJ. Pratica clinica. Insufficienza di vitamina D Ngl
J Med 2011; 364: 248-254 [PMID: 21247315 DOI: 10.1056 /
NEJMcp1009570]
219 Pittas AG, Chung M, Trikalinos T, Mitri J, Brendel M, Patel K,
Lichtenstein AH, Lau J, Balk EM. Revisione sistematica: vitamina
D e risultati cardiometabolici. Ann Intern Med 2010; 152:
307-314 [PMID: 20194237 DOI: 10.7326/0003-4819-152-5-2010
03020-00009]
220 Motiwala SR, Wang TJ. Vitamina D e malattie cardiovascolari.
Curr Opin Nephrol Hypertens 2011; 20: 345-353 [PMID:
21519252 DOI: 10.1097/MNH.0b013e3283474985]
221 Bhandari SK, Pashayan S, Liu IL, Rasgon SA, Kujubu DA,
Tom TY, Sim JJ. Livelli di 25-idrossivitamina D e ipertensione
aliquote. J Clin Hypertens (Greenwich) 2011; 13: 170-177
[PMID: 21366848 DOI: 10.1111 / j.1751-7176.2010.00408.x]
222 Kienreich K, Tomaschitz A, Verheyen N, Pieber TR, Pilz S.
Vitamina D e ipertensione arteriosa: cura la carenza!
Am J Hypertens 2013; 26: 158 [PMID: 23382398 DOI: 10.1093 /
ajh / hps058]
223 Tamez H, Kalim S, Thadhani RI. La vitamina D modula
pressione sanguigna? Curr Opin Nephrol Hypertens 2013; 22: 204-209
[PMID: 23299053 DOI: 10.1097 / MNH.0b013e32835d919b]
224 Wang L, Ma J, Manson JE, Buring JE, Gaziano JM, Sesso HD.
Uno studio prospettico sui metaboliti plasmatici della vitamina D, vitamina
Polimorfismi del gene del recettore D e rischio di ipertensione
negli uomini Eur J Nutr 2013; 52: 1771-1779 [PMID: 23262750
DOI: 10.1007/s00394-012-0480-8]
225 Pfeifer M, Begerow B, Minne HW, Nachtigall D, Hansen C.
Effetti di una vitamina D a breve termine (3) e integrazione di calcio sulla pressione sanguigna e sui livelli di ormone paratiroideo nelle donne anziane. J Clin Endocrinol Metab 2001; 86: 1633-1637 [PMID: 11297596 DOI: 10.1210 / jc.86.4.1633]
226 Keniston R, Enriquez J Sr. Rapporto tra pressione sanguigna
e livelli di vitamina B6 nel plasma in buona salute
Adulti. Ann NY Acad Sci 1990; 585: 499-501 [DOI: 10.1111 /
j.1749-6632.1990.tb28087.x]
227 Aybak M, Sermet A, Ayyildiz MO, Karakil ik AZ. Effetto di
supplementazione orale di piridossina cloridrato su arteriosa
pressione sanguigna in pazienti con ipertensione essenziale. Arzneimittelforschung
1995; 45: 1271-1273 [PMID: 8595083]
228 Paulose CS, Dakshinamurti K, Packer S, Stephens NL. Comprensivo
stimolazione e ipertensione nel pyridoxinedeficient
ratto adulto Ipertensione 1988; 11: 387-391 [PMID:
3356457 DOI: 10.1161 / 01.HYP.11.4.387]
229 Dakshinamurti K, Lal KJ, Ganguly PK. Ipertensione, calcio
canale e piridossina (vitamina B6). Mol Cell Biochem
1998; 188: 137-148 [PMID: 9823019]
230 Moline J, Bukharovich IF, Wolff MS, Phillips R. Dietary
flavonoidi e ipertensione: esiste un collegamento? Med
Ipotesi 2000; 55: 306-309 [PMID: 11000057 DOI:
10.1054/ mehy.2000.1057]
231 Knekt P, Reunanen A, J rvinen R, Sepp nen R, Heli vaara
M, Aromaa A. Assunzione di vitamina antiossidante e coronaria
mortalità in uno studio longitudinale della popolazione. Am J Epidemiol
1994; 139: 1180-1189 [PMID: 8209876]
232 Karatzi KN, Papamichael CM, Karatzis EN, Papaioannou
TG, Aznaouridis KA, Katsichti PP, Stamatelopoulos KS,
Zampelas A, Lekakis JP, Mavrikakis ME. Vino rosso acutamente
induce effetti favorevoli su riflessi ondulati e centrali
pressioni nei pazienti con malattia coronarica. Am J Hypertens
2005; 18: 1161-1167 [PMID: 16182104 DOI: 10.1016/ j.amjhyper.2005.03.744]
233 Biala A, Tauriainen E, Siltanen A, Shi J, Merasto S, Louhelainen
M, Martonen E, Finckenberg P, Muller DN, Mervaala
E. Il resveratrolo induce la biogenesi mitocondriale e migliora
Rimodellamento cardiaco indotto da Ang II in ratti transgenici
che ospita geni umani renina e angiotensinogeno. Sangue
Premere 2010; 19: 196-205 [PMID: 20429690 DOI: 10.3109 / 08037
051.2010.481808]
234 Wong RH, Howe PR, Buckley JD, Coates AM, Kunz I,
Berry NM. La supplementazione acuta di resveratrolo migliora
dilatazione flusso-mediata in individui sovrappeso / obesi
con una pressione del sangue leggermente elevata. Nutr Metab Cardiovasc
Dis 2011; 21: 851-856 [PMID: 20674311 DOI: 10.1016 /
j.numecd.2010.03.003]
235 Bhatt SR, Lokhandwala MF, Banday AA. Resveratrol previene
disaccoppiamento dell'ossido nitrico endoteliale sintetasi e
attenua lo sviluppo di ipertensione spontaneamente
ratti ipertesi. Eur J Pharmacol 2011; 667: 258-264 [PMID:
21640096 DOI: 10.1016 / j.ejphar.2011.05.026]
236 Rivera L, Morn R, Zarzuelo A, Galisteo M. Resveratrolo a lungo termine
la somministrazione riduce i disturbi metabolici e
abbassa la pressione sanguigna nei ratti obesi Zucker. Biochem Pharmacol
2009; 77: 1053-1063 [PMID: 19100718 DOI: 10.1016 /
j.bcp.2008.11.027]
237 Paran E, Engelhard YN. Effetto di licopene, un naturale orale
antiossidante sulla pressione sanguigna. J Hypertens 2001; 19: S74. Astratto
P1.204
238 Engelhard YN, Gazer B, Paran E. Antiossidanti naturali
dall'estratto di pomodoro ridurre la pressione sanguigna nei pazienti con
ipertensione di grado 1: un doppio cieco, controllato con placebo
studio pilota. Am Heart J 2006; 151: 100 [PMID: 16368299]
239 Paran E, Novack V, Engelhard YN, Hazan-Halevy I. Gli effetti
di antiossidanti naturali dall'estratto di pomodoro in trattamento
ma pazienti ipertesi non controllati. Farmaci cardiovascolari
Il 2009; 23: 145-151 [PMID: 19052855 DOI: 10.1007/ s10557
-008-6155-2]
240 Ried K, Frank OR, Azioni NP. Cioccolato fondente o pomodoro
estratto per preipertensione: uno studio controllato randomizzato.
BMC Complement Altern Med 2009; 9: 22 [PMID: 19583878
DOI: 10.1186/1472-6882-9-22]
241 Paran E, Engelhard Y. P-333: Effetto del licopene di pomodoro su
pressione sanguigna, lipoproteine sieriche, omocisteina plasmatica
e marcatori di stress ossidativo nei pazienti ipertesi di I grado.
Am J Hypertens 2001; 14: 141A. P-333 astratto [DOI:
10.1016/S0895-7061(01)01854-4]
242 Xaplanteris P, Vlachopoulos C, Pietri P, Terentes-Printzios D,
Kardara D, Alexopoulos N, Aznaouridis K, Miliou A, Stefanadis
C. L'integrazione di concentrato di pomodoro migliora l'endoteliale
dinamica e riduce lo stato ossidativo totale del plasma in
soggetti sani. Nutr Res 2012; 32: 390-394 [PMID: 22652379
DOI: 10.1016 / j.nutres.2012.03.011]
243 Hosseini S, Lee J, Sepulveda RT, Rohdewaldc P, Watson
RR. Una prospettiva randomizzata, in doppio cieco, controllata con placebo
16 settimana crossover studio per determinare il ruolo di
picnogenolo nel modificare la pressione sanguigna in lieve ipertensione
pazienti. Nutr Res 2001; 21: 1251-1260 [DOI: 10.1016 /
S0271-5317(01)00342-6]
244 Zibadi S, Rohdewald PJ, Park D, Watson RR. Riduzione di
fattori di rischio cardiovascolare in soggetti con diabete tipo 2
con l'integrazione di Picnogenolo. Nutr Res 2008; 28: 315-320
[PMID: 19083426 DOI: 10.1016 / j.nutres.2008.03.003]
245 Liu X, Wei J, Tan F, Zhou S, W rthwein G, Rohdewald P.
Il picnogenolo, estratto di corteccia di pino marittimo francese, migliora
funzione endoteliale dei pazienti ipertesi. Life Sci 2004;
74: 855-862 [PMID: 14659974 DOI: 10.1016 / j.lfs.2003.07.037]
246 van der Zwan LP, Scheffer PG, Teerlink T. Riduzione di
attività di mieloperossidasi da parte della melatonina e del picnogenolo
contribuire al loro effetto di abbassamento della pressione sanguigna. Ipertensione
2010; 56: e34; risposta dell'autore e35 [PMID: 20696986 DOI:
10.1161 / HYPERTENSIONAHA.110.158170]
247 Cesarone MR, Belcaro G, Stuard S, Schnlau F, Di Renzo
A, Grossi MG, Dugall M, Cornelli U, Cacchio M, Gizzi G,
Pellegrini L. Flusso renale e funzione nell'ipertensione: protettiva
effetti del picnogenolo nei partecipanti ipertesi-a
studio controllato J Cardiovasc Pharmacol Ther 2010; 15: 41-46
[PMID: 20097689 DOI: 10.1177 / 1074248409356063]
248 Simons S, Wollersheim H, Thien T. Una revisione sistematica su
l'influenza della qualità della prova sull'effetto dell'aglio sul sangue
pressione. Neth J Med 2009; 67: 212-219 [PMID: 19749390]
249 Reinhart KM, Coleman CI, Teevan C, Vachhani P, Bianco
CENTIMETRO. Effetti dell'aglio sulla pressione sanguigna in pazienti con e
senza ipertensione sistolica: una meta-analisi. Ann Pharmacother
2008; 42: 1766-1771 [PMID: 19017826 DOI: 10.1345 /
aph.1L319]
250 Ried K, Frank OR, Azioni NP. L'estratto di aglio invecchiato si abbassa
pressione arteriosa in pazienti trattati ma non controllati
ipertensione: uno studio controllato randomizzato. Maturitas
2010; 67: 144-150 [PMID: 20594781 DOI: 10.1016/ j.maturitas.2010.06.001]
251 Suetsuna K, Nakano T. Identificazione di un antiipertensivo
peptide dal digest peptic di wakame (Undaria pinnatifida).
J Nutr Biochem 2000; 11: 450-454 [PMID: 11091100 DOI:
10.1016/S0955-2863(00)00110-8]
252 Nakano T, Hidaka H, Uchida J, Nakajima K, Hata Y. Ipotente
effetti di wakame. J Jpn Soc Clin Nutr 1998; 20: 92
253 Krotkiewski M, Aurell M, Holm G, Grimby G, Szczepanik
J. Effetti di un'alga con scambio ionico di sodio e potassio
preparazione in lieve ipertensione. Am J Hypertens 1991; 4:
483-488 [PMID: 1873002 DOI: 10.1093 / ajh / 4.6.483]
254 Sato M, Oba T, Yamaguchi T, Nakano T, Kahara T, Funayama
K, Kobayashi A, Nakano T. Effetti antiipertensivi
di idrolizzati di wakame (Undaria pinnatifida) e
la loro attività inibitoria dell'enzima di conversione dell'angiotensina-I.
Ann Nutr Metab 2002; 46: 259-267 [PMID: 12464726 DOI:
10.1159 / 000066495]
255 Sato M, Hosokawa T, Yamaguchi T, Nakano T, Muramoto
K, Kahara T, Funayama K, Kobayashi A, Nakano T. Angiotensin
Peptidi inibitori dell'enzima di conversione I derivati da
wakame (Undaria pinnatifida) e il loro antiipertensivo
effetto su ratti spontaneamente ipertesi. J Agric Food Chem2002; 50: 6245-6252 [PMID: 12358510 DOI: 10.1021 / jf020482t]
256 Sankar D, Sambandam G, Ramakrishna Rao M, Pugalendi
KV. Modulazione della pressione sanguigna, profili lipidici e redox
stato nei pazienti ipertesi che assumono diversi oli commestibili.
Clin Chim Acta 2005; 355: 97-104 [PMID: 15820483 DOI:
10.1016 / j.cccn.2004.12.009]
257 Sankar D, Rao MR, Sambandam G, Pugalendi KV. Effetto di
olio di sesamo su diuretici o beta-bloccanti nella modulazione
di pressione sanguigna, antropometria, profilo lipidico e redox
stato. Yale J Biol Med 2006; 79: 19-26 [PMID: 17876372]
258 Miyawaki T, Aono H, Toyoda-Ono Y, Maeda H, Kiso Y,
Moriyama K. Effetti antipertensivi di sesamina nell'uomo.
J Nutr Sci Vitaminol (Tokyo) 2009; 55: 87-91 [PMID: 19352068]
259 Wichitsranoi J, Weerapreeyakul N, Boonsiri P, Settasatian
C, Settasatian N, Komanasin N, Sirijaichingkul S, Teerajetgul
Y, Rangkadilok N, Leelayuwat N. Antipertensivo
e antiossidanti del pasto dietetico di sesamo nero in preipertensivo
gli esseri umani. Nutr J 2011; 10: 82 [PMID: 21827664
DOI: 10.1186/1475-2891-10-82]
260 Sudhakar B, Kalaiarasi P, Al-Numair KS, Chandramohan G,
Rao RK, Pugalendi KV. Effetto della combinazione di oli commestibili
sulla pressione sanguigna, sul profilo lipidico, sui marcatori perossidici lipidici,
stato antiossidante ed elettroliti nei pazienti con ipertensione
sul trattamento con nifedipina. Saudi Med J 2011; 32: 379-385
[PMID: 21483997]
261 Sankar D, Rao MR, Sambandam G, Pugalendi KV. Un pilota
studio di olio di sesamo in aperto in diabetici ipertesi. J
Med Food 2006; 9: 408-412 [PMID: 17004907 DOI: 10.1089 /
jmf.2006.9.408]
262 Harikumar KB, Sung B, Tharakan ST, Pandey MK, Joy B,
Guha S, Krishnan S, Aggarwal BB. Sesamina manifesta la chemopreventivo
effetti attraverso la soppressione di NF-kappa
Sopravvivenza, proliferazione, invasione e angiogenicità delle cellule regolate con B
prodotti genetici. Mol Cancer Res 2010; 8: 751-761 [PMID:
20460401 DOI: 10.1158/1541-7786.MCR-09-0565]
263 Nakano D, Ogura K, Miyakoshi M, Ishii F, Kawanishi H, Kurumazuka
D, Kwak CJ, Ikemura K, Takaoka M, Moriguchi S,
Iino T, Kusumoto A, Asami S, Shibata H, Kiso Y, Matsumura
Y. Effetto antipertensivo dell'enzima di conversione dell'angiotensina I
peptidi inibitori da un idrolizzato di proteine del sesamo
in ratti spontaneamente ipertesi. Biosci Biotechnol Biochem
2006; 70: 1118-1126 [PMID: 16717411]
264 Karatzi K, Stamatelopoulos K, Lykka M, Mantzouratou
P, Skalidi S, Manios E, Georgiopoulos G, Zakopoulos N,
Papamichael C, Sidossis LS. Emodinamico acuto ea lungo termine
effetti del consumo di olio di sesamo in ipertesi
uomini. J Clin Hypertens (Greenwich) 2012; 14: 630-636 [PMID:
22947362 DOI: 10.1111 / j.1751-7176.2012.00649.x]
265 Hodgson JM, Puddey IB, Burke V, Beilin LJ, Jordan N. Effetti
sulla pressione sanguigna di bere tè verde e nero. J
Hypertens 1999; 17: 457-463 [PMID: 10404946 DOI: 10.1097 / 0
0004872-199917040-00002]
266 Kurita I, Maeda-Yamamoto M, Tachibana H, Kamei M.
Effetto antiipertensivo del tè Benifuuki contenente O-metilato
EGCG. J Agric Food Chem 2010; 58: 1903-1908 [PMID:
20078079 DOI: 10.1021 / jf904335g]
267 McKay DL, Chen CY, Saltzman E, Blumberg JB. Ibisco
il tè sabdariffa L. (tisana) abbassa la pressione sanguigna in preipertensivo
e lievemente ipertesi. J Nutr 2010; 140:
298-303 [PMID: 20018807 DOI: 10.3945 / jn.109.115097]
268 Bogdanski P, Suliburska J, Szulinska M, Stepien M, PupekMusialik
D, Jablecka A. L'estratto di tè verde riduce il sangue
pressione, biomarcatori infiammatori e stress ossidativo
e migliora i parametri associati alla resistenza all'insulina
in pazienti obesi e ipertesi. Nutr Res 2012; 32: 421-427
[PMID: 22749178 DOI: 10.1016 / j.nutres.2012.05.007]
269 Hodgson JM, Woodman RJ, Puddey IB, Mulder T, Fuchs
D, Croft KD. Effetti a breve termine del tè nero ricco di polifenoli
sulla pressione sanguigna negli uomini e nelle donne. Food Funct 2013; 4:
111-115 [PMID: 23038021 DOI: 10.1039 / c2fo30186e]
270 Medina-Rem n A, Estruch R, Tresserra-Rimbau A, Vallverd -Queralt A, Lamuela-Raventos RM. L'effetto dei polifenoli
consumo sulla pressione sanguigna. Mini Rev Med Chem
2013; 13: 1137-1149 [PMID: 22931531]
271 Jimnez R, Duarte J, Perez-Vizcaino F. Epicatechina: endoteliale
funzione e pressione sanguigna. J Agric Food Chem 2012; 60:
8823-8830 [PMID: 22440087 DOI: 10.1021 / jf205370q]
272 Taubert D, Roesen R, Sch mig E. Effetto del cacao e del tè
assunzione sulla pressione sanguigna: una meta-analisi. Arch Intern Med
2007; 167: 626-634 [PMID: 17420419 DOI: 10.1001/ archinte.16
7.7.626]
273 Grassi D, Lippi C, Necozione S, Desideri G, Ferri C. Shortterm
la somministrazione di cioccolato fondente è seguita da a
aumento significativo della sensibilità all'insulina e una diminuzione in
pressione sanguigna in persone sane. Am J Clin Nutr 2005; 81:
611-614 [PMID: 15755830]
274 Taubert D, Roesen R, Lehmann C, Jung N, Sch mig E. Effects
di basso apporto di cacao abituale alla pressione sanguigna e bioattivo
ossido nitrico: uno studio controllato randomizzato. JAMA 2007;
298: 49-60 [PMID: 17609490 DOI: 10.1001 / jama.298.1.49]
275 Cohen DL, Townsend RR. Ingestione di cacao e ipertensione - un altro
tazza per favore? J Clin Hypertens (Greenwich)
2007; 9: 647-648 [PMID: 17673887 DOI: 10.1111 /
j.1524-6175.2007.07291.x]
276 Ried K, Sullivan T, Fakler P, Frank OR, Azioni NP. fa
il cioccolato riduce la pressione sanguigna? Una meta-analisi. BMC Med
2010; 8: 39 [PMID: 20584271 DOI: 10.1186 / 1741-7015-8-39]
277 Egan BM, Laken MA, Donovan JL, Woolson RF. Fa buio
il cioccolato ha un ruolo nella prevenzione e nella gestione di
ipertensione ?: commento sulle prove. Ipertensione
2010; 55: 1289-1295 [PMID: 20404213 DOI: 10.1161 / HYPERTENSIONAHA.110.151522]
278 Desch S, Kobler D, Schmidt J, Sonnabend M, Adams V,
Sareban M, Eitel I, Bl her M, Schuler G, Thiele H. Low vs.
cioccolato fondente a dosi elevate e pressione arteriosa in cardiovascolare
pazienti ad alto rischio. Am J Hypertens 2010; 23: 694-700
[PMID: 20203627 DOI: 10.1038 / ajh.2010.29]
279 Desch S, Schmidt J, Kobler D, Sonnabend M, Eitel I, Sareban
M, Rahimi K, Schuler G, Thiele H. Effetto dei prodotti di cacao
sulla pressione sanguigna: revisione sistematica e meta-analisi. am
J Hypertens 2010; 23: 97-103 [PMID: 19910929 DOI: 10.1038 /
ajh.2009.213]
280 Grassi D, Desideri G, Necozione S, Lippi C, Casale R,
Properzi G, Blumberg JB, Ferri C. La pressione sanguigna è ridotta
e sensibilità all'insulina aumentata in intolleranti al glucosio, ipertesi
soggetti dopo 15 giorni di consumo di alto polifenolo
cioccolato fondente. J Nutr 2008; 138: 1671-1676 [PMID: 18716168]
281 Grassi D, Necozione S, Lippi C, Croce G, Valeri L, Pasqualetti
P, Desideri G, Blumberg JB, Ferri C. Il cacao riduce il sangue
pressione e insulino-resistenza e migliora l'endoteliodipendente
vasodilatazione in ipertensivi. Ipertensione
2005; 46: 398-405 [PMID: 16027246 DOI: 10.1161 / 01.
HYP.0000174990.46027.70]
282 Ellinger S, Reusch A, Stehle P, Helfrich HP. epicatechina
ingerito tramite prodotti a base di cacao riduce la pressione sanguigna in
umani: un modello di regressione non lineare con un approccio bayesiano.
Am J Clin Nutr 2012; 95: 1365-1377 [PMID: 22552030
DOI: 10.3945 / ajcn.111.029330]
283 Hooper L, Kay C, Abdelhamid A, Kroon PA, Cohn JS, Rimm
EB, Cassidy A. Effetti di cioccolato, cacao e flavan-3-ols
sulla salute cardiovascolare: una revisione sistematica e una meta-analisi
di studi randomizzati. Am J Clin Nutr 2012; 95: 740-751
[PMID: 22301923 DOI: 10.3945 / ajcn.111.023457]
284 Yamaguchi T, Chikama A, Mori K, Watanabe T, Shioya Y,
Katsuragi Y, Tokimitsu I. Caffè senza idrossiclochinone:
uno studio dose-risposta controllato randomizzato in doppio cieco
della pressione sanguigna. Nutr Metab Cardiovasc Dis 2008; 18: 408-414
[PMID: 17951035 DOI: 10.1016 / j.numecd.2007.03.004]
285 Chen ZY, Peng C, Jiao R, Wong YM, Yang N, Huang Y.
Nutraceutici anti-ipertensivi e alimenti funzionali. J
Agric Food Chem 2009; 57: 4485-4499 [PMID: 19422223 DOI:
10.1021 / jf900803r]
286 Ochiai R, Chikama A, Kataoka K, Tokimitsu I, Maekawa Y,
Ohishi M, Rakugi H, Mikami H. Effetti di idrossi-idrochinone-ridotto
caffè su vasoreattività e pressione sanguigna.
Hypertens Res 2009; 32: 969-974 [PMID: 19713967 DOI:
10.1038 / hr.2009.132]
287 Kozuma K, Tsuchiya S, Kohori J, Hase T, Tokimitsu I. Antiipertensivo
effetto dell'estratto di caffè verde in grani
soggetti ipertesi. Hypertens Res 2005; 28: 711-718 [PMID:
16419643 DOI: 10.1291 / hypres.28.711]
288 Palatini P, Ceolotto G, Ragazzo F, Dorigatti F, Saladini F,
Papparella I, Mos L, Zanata G, Santonastaso M. CYP1A2
il genotipo modifica l'associazione tra l'assunzione di caffè
e il rischio di ipertensione. J Hypertens 2009; 27: 1594-1601
[PMID: 19451835 DOI: 10.1097 / HJH.0b013e32832ba850]
289 Scheer FA, Van Montfrans GA, van Someren EJ, Mairuhu
G, Buijs RM. La melatonina notturna quotidiana riduce la pressione sanguigna
nei pazienti maschi con ipertensione essenziale. Ipertensione
2004; 43: 192-197 [PMID: 14732734 DOI: 10.1161 / 01.
HYP.0000113293.15186.3b]
290 Cavallo A, Daniels SR, Dolan LM, Khoury JC, Bean JA.
Risposta della pressione arteriosa alla melatonina nel diabete tipo 1.
Diabete Pediatrico 2004; 5: 26-31 [PMID: 15043687 DOI: 10.1111
/ j.1399-543X.2004.00031.x]
291 Cavallo A, Daniels SR, Dolan LM, Bean JA, Khoury JC.
Effetto ipolipemizzante della melatonina nel diabete tipo 1.
J Pineal Res 2004; 36: 262-266 [PMID: 15066051 DOI:
10.1111 / j.1600-079X.2004.00126.x]
292 Cagnacci A, Cannoletta M, Renzi A, Baldassari F, Arangino
S, Volpe A. La somministrazione prolungata di melatonina diminuisce
pressione sanguigna notturna nelle donne. Am J Hypertens 2005; 18:
1614-1618 [PMID: 16364834]
293 Grossman E, Laudon M, Yalcin R, Zengil H, Peleg E, Sharabi
Y, Kamari Y, Shen-Orr Z, Zisapel N. Melatonin riduce la notte
pressione sanguigna in pazienti con ipertensione notturna. am
J Med 2006; 119: 898-902 [PMID: 17000226 DOI: 10.1016 /
j.amjmed.2006.02.002]
294 Rechci?ski T, Kurpesa M, Trzos E, Krzeminska-Paku?a M.
[L'influenza della supplementazione di melatonina su circadiano
modello di pressione sanguigna in pazienti con arteria coronaria
rapporto preliminare sulla malattia]. Pol Arch Med Wewn 2006; 115:
520-528 [PMID: 17263223]
295 Merkureeva GA, Ryzhak GA. [Effetto del peptide della ghiandola pineale
preparazione sul profilo diurno della pressione arteriosa in
donne di mezza età e anziane con cardiopatia ischemica
e ipertensione arteriosa]. Adv Gerontol 2008; 21: 132-142
[PMID: 18546838]
296 Zaslavskaia RM, Shcherban EA, Logvinenko SI. [Melatonina
in terapia combinata di pazienti con angina stabile e arteriosa
ipertensione]. Klin Med (Mosk) 2008; 86: 64-67 [PMID:
19048842]
297 Zamotaev IuN, Enikeev AKh, Kolomoets NM. [L'uso di
melaxen in terapia combinata di ipertensione arteriosa in
soggetti occupati nella produzione della catena di montaggio]. Klin Med
(Mosk) 2009; 87: 46-49 [PMID: 19670717]
298 Rechci?ski T, Trzos E, Wierzbowska-Drabik K, Krzemi?skaPaku?a
M, Kurpesa M. Melatonin per nondippers con coronaria
malattia arteriosa: valutazione del profilo della pressione arteriosa e
variabilità del battito cardiaco. Hypertens Res 2010; 33: 56-61 [PMID:
19876062 DOI: 10.1038 / hr.2009.174]
299 Kozir g M, Poliwczak AR, Duchnowicz P, Koter-Michalak
Migliora il trattamento con M, Sikora J, Broncel M. Melatonin
pressione sanguigna, profilo lipidico e parametri ossidativi
stress in pazienti con sindrome metabolica. J Pineal Res
2011; 50: 261-266 [PMID: 21138476 DOI: 10.1111 / j.1600-
079X.2010.00835.x]
300 De Leersnyder H, de Blois MC, Vekemans M, Sidi D, Villain
E, Kindermans C, Munnich A. beta (1) -antagonisti adrenergici
migliorare il sonno e disturbi comportamentali in un circadiano
disturbo, sindrome di Smith-Magenis. J Med Genet 2001; 38:
586-590 [PMID: 11546826]
301 Morand C, Dubray C, Milenkovic D, Lioger D, Martin JF,
Scalbert A, Mazur A. Hesperidin contribuisce alla vascolarizzazione
effetti protettivi del succo d'arancia: un crossover randomizzato
studiare in volontari sani. Am J Clin Nutr 2011; 93: 73-80
[PMID: 21068346 DOI: 10.3945 / ajcn.110.004945]
302 Basu A, Penugonda K. Succo di melograno: un cuore sano
succo di frutta. Nutr Rev 2009; 67: 49-56 [PMID: 19146506 DOI:
10.1111 / j.1753-4887.2008.00133.x]
303 Aviram M, Rosenblat M, Gaitini D, Nitecki S, Hoffman A,
Dornfeld L, Volkova N, Presser D, Attias J, Liker H, Hayek
T. consumo di succo di melograno per gli anni 3 dai pazienti
con la stenosi dell'arteria carotidea si riduce la comune intimità della carotide
spessore, pressione sanguigna e ossidazione delle LDL. clin
noce 2004; 23: 423-433 [PMID: 15158307 DOI: 10.1016/ j.
clnu.2003.10.002]
304 Aviram M, Dornfeld L. Consumo di succo di melograno
inibisce l'attività dell'enzima di conversione dell'angiotensina sierica e
riduce la pressione sanguigna sistolica. Aterosclerosi 2001; 158:
195-198 [PMID: 11500191]
305 Feringa HH, Laskey DA, Dickson JE, Coleman CI. L'effetto
di estratto di semi d'uva su marcatori di rischio cardiovascolare:
una meta-analisi di studi randomizzati controllati. J Am Diet
Associazione 2011; 111: 1173-1181 [PMID: 21802563 DOI: 10.1016/ j.
jada.2011.05.015]
306 Sivaprakasapillai B, Edirisinghe I, Randolph J, Steinberg
F, Kappagoda T. Effetto dell'estratto di semi d'uva sulla pressione sanguigna
in soggetti con la sindrome metabolica. Metabolismo
2009; 58: 1743-1746 [PMID: 19608210 DOI: 10.1016/ j.metabol.2009.05.030]
307 Edirisinghe I, Burton-Freeman B, Tissa Kappagoda C. Meccanismo
del rilassamento dipendente dall'endotelio evocato da a
estratto di semi d'uva. Clin Sci (Lond) 2008; 114: 331-337 [PMID:
17927567 DOI: 10.1042 / CS20070264]
308 Rosenfeldt FL, Haas SJ, Krum H, Hadj A, Ng K, Leong JY,
Watts GF. Coenzima Q10 nel trattamento dell'ipertensione: a
meta-analisi degli studi clinici. J Hum Hypertens 2007; 21:
297-306 [PMID: 17287847]
309 Burke BE, Neuenschwander R, Olson RD. Randomizzato,
prova in doppio cieco, controllata con placebo del coenzima Q10
nell'ipertensione sistolica isolata. South Med J 2001; 94:
1112-1117 [PMID: 11780680 DOI: 10.1097 / 00007611-20011100
0-00015]
310 Mikhin VP, Kharchenko AV, Rosliakova EA, Cherniatina
MA. [Applicazione del coenzima Q (10) in terapia combinata
di ipertensione arteriosa]. Kardiologiia 2011; 51: 26-31 [PMID:
21878067]
311 Tsai KL, Huang YH, Kao CL, Yang DM, Lee HC, Chou HY,
Chen YC, Chiou GY, Chen LH, Yang YP, Chiu TH, Tsai CS,
Ou HC, Chiou SH. Un nuovo meccanismo di coenzima Q10
protegge contro le cellule endoteliali umane da ossidanti
danno indotto da stress modulando i percorsi correlati a NO.
J Nutr Biochem 2012; 23: 458-468 [PMID: 21684136 DOI:
10.1016 / j.jnutbio.2011.01.011]
312 Sohet FM, Delzenne NM. C'è un posto per il coenzima Q
nella gestione dei disturbi metabolici associati a
obesità? Nutr Rev 2012; 70: 631-641 [PMID: 23110642 DOI:
10.1111 / j.1753-4887.2012.00526.x]
313 Digiesi V, Cantini F, Oradei A, Bisi G, Guarino GC, Brocchi
A, Bellandi F, Mancini M, Littarru GP. Coenzima Q10
in ipertensione essenziale. Mol Aspects Med 1994; 15 Suppl:
s257-s263 [PMID: 7752838]
314 Langsjoen P, Langsjoen P, Willis R, Folkers K. Trattamento di
ipertensione essenziale con il coenzima Q10. Aspetti Mol Med
1994; 15 Suppl: S265-S272 [PMID: 7752851 DOI: 10.1016 / 009
8-2997 (94) 90037-X]
315 Ankola DD, Viswanad B, Bhardwaj V, Ramarao P, Kumar
MN. Sviluppo di una potente formulazione di nanoparticelle orali
di coenzima Q10 per il trattamento dell'ipertensione: can
i semplici integratori alimentari vanno usati come prima linea
agenti terapeutici per la profilassi / terapia? Eur J Pharm
Biopharm 2007; 67: 361-369 [PMID: 17452099 DOI: 10.1016 /
j.ejpb.2007.03.010]
316 Trimarco V, Cimmino CS, Santoro M, Pagnano G, Manzi
MV, Piglia A, Giudice CA, De Luca N, Izzo R. Nutraceuticals
per il controllo della pressione arteriosa in pazienti con alto-normale o
ipertensione 1 di grado. High Blood Press Cardiovasc Indietro 2012;
19: 117-122 [PMID: 22994579 DOI: 10.2165 / 11632160-0000000
00-00000]
317 Young JM, Florkowski CM, Molyneux SL, McEwan RG,
Frampton CM, Nicholls MG, Scott RS, George PM. A randomized,
studio crossover in doppio cieco, controllato con placebo
della terapia con coenzima Q10 in pazienti ipertesi con
sindrome metabolica. Am J Hypertens 2012; 25: 261-270 [PMID:
22113168 DOI: 10.1038 / ajh.2011.209]
318 McMackin CJ, Widlansky ME, Hamburg NM, Huang AL,
Weller S, Holbrook M, Gokce N, Hagen TM, Keaney JF, Vita
JA. Effetto del trattamento combinato con acido alfa-lipoico e
acetil-L-carnitina sulla funzione vascolare e sulla pressione sanguigna
in pazienti con malattia coronarica. J Clin Hypertens
(Greenwich) 2007; 9: 249-255 [PMID: 17396066 DOI: 10.1111 /
j.1524-6175.2007.06052.x]
319 Salinthone S, Schillace RV, Tsang C, Regan JW, Bourdette
DN, Carr DW. L'acido lipoico stimola la produzione di cAMP
via G recettore-dipendente e recettore-dipendente
meccanismi. J Nutr Biochem 2011; 22: 681-690 [PMID:
21036588 DOI: 10.1016 / j.jnutbio.2010.05.008]
320 Rahman ST, Mercante N, Haque T, Wahi J, Bhaheetharan S,
Ferdinand KC, Khan BV. L'impatto dell'acido lipoico sull'endoteliale
funzione e proteinuria nel diabetico trattato con quinapril
pazienti con ipertensione di stadio I: risultati dalla QUALITÀ
studia. J Cardiovasc Pharmacol Ther 2012; 17: 139-145 [PMID:
21750253 DOI: 10.1177 / 1074248411413282]
321 Morcos M, Borcea V, Isermann B, Gehrke S, Ehret T, Henkels
M, Schiekofer S, Hofmann M, Amiral J, Tritschler H,
Ziegler R, Wahl P, Nawroth PP. Effetto dell'acido alfa-lipoico su
la progressione del danno delle cellule endoteliali e dell'albuminuria
in pazienti con diabete mellito: uno studio esplorativo. Diabete
Res Clin Pract 2001; 52: 175-183 [PMID: 11323087]
322 Jiang B, Haverty M, Brecher P. N-acetil-L-cisteina migliora
espressione di interleuchina-1beta indotta da ossido nitrico sintasi.
Ipertensione 1999; 34: 574-579 [PMID: 10523329]
323 Vasdev S, Singal P, Gill V. L'effetto antiipertensivo di
cisteina. Int J Angiol 2009; 18: 7-21 [PMID: 22477470 DOI:
10.1055 / s-0031-1278316]
324 Meister A, Anderson ME, Hwang O. Cysteine intracellulare
e sistemi di consegna del glutatione. J Am Coll Nutr 1986; 5:
137-151 [PMID: 3722629 DOI: 10.1080 / 07315724.1986.107201
21]
325 Asher GN, Viera AJ, Weaver MA, Dominik R, Caughey M,
Hinderliter AL. Effetto dell'estratto standardizzato di biancospino su
dilatazione mediata dal flusso in prehypertensive e lievemente ipertensive
adulti: un trial crossover randomizzato e controllato.
BMC Complement Altern Med 2012; 12: 26 [PMID: 22458601
DOI: 10.1186/1472-6882-12-26]
326 Ko yildiz ZC, Birman H, Olga V, Akg n-Dar K, Meliko?lu
G, Meri li AH. L'estratto di foglie di Crataegus tanacetifolia previene
Ipertensione indotta da L-NAME nei ratti: una morfologica
studia. Phytother Res 2006; 20: 66-70 [PMID: 16397846 DOI:
10.1002 / ptr.1808]
327 Schrüder D, Weiser M, Klein P. Efficacia di un omeopatico
Preparazione di Crataegus rispetto alla terapia abituale per
insufficienza cardiaca lieve (NYHA II): risultati di un'osservazione
studio di coorte. Eur J Heart Fail 2003; 5: 319-326 [PMID:
12798830 DOI: 10.1016/S1388-9842(02)00237-4]
328 Walker AF, Marakis G, Simpson E, Hope JL, Robinson PA,
Hassanein M, Simpson HC. Effetti ipotensivi del biancospino
per i pazienti diabetici che assumono farmaci da prescrizione: a
prova controllata randomizzata. Br J Gen Pract 2006; 56: 437-443
[PMID: 16762125]
329 Walker AF, Marakis G, Morris AP, Robinson PA. Promettente
effetto ipotensivo dell'estratto di biancospino: un doppio cieco randomizzato
studio pilota di ipertensione lieve, essenziale. Phytother
Ris 2002; 16: 48-54 [PMID: 11807965 DOI: 10.1002/ ptr.947]
330 Larson A, Witman MA, Guo Y, Ives S, Richardson RS, Bruno
RS, Jalili T, Symons JD. Riduzioni acute e causate dalla quercetina
nella pressione sanguigna in individui ipertesi non sono secondari
abbassare l'attività dell'enzima di conversione dell'angiotensina nel plasma
o endotelina-1: ossido nitrico. Nutr Res 2012; 32: 557-564
[PMID: 22935338 DOI: 10.1016 / j.nutres.2012.06.018]
331 Edwards RL, Lyon T, Litwin SE, Rabovsky A, Symons JD,
Jalili T. La quercetina riduce la pressione sanguigna in ipertensione
soggetti. J Nutr 2007; 137: 2405-2411 [PMID: 17951477]
332 Egert S, Bosy-Westphal A, Seiberl J, KÃrbitz C, Settler U,
Plachta-Danielzik S, Wagner AE, Frank J, Schrezenmeir J,
Rimbach G, Wolffram S, Müller MJ. La quercetina riduce la sistolica
lipoproteine a bassa densità ossidate al plasma e pressione sanguigna
concentrazioni in soggetti sovrappeso con un alto rischio cardiovascolare
fenotipo del rischio di malattia: a doppio cieco, controllato da luogo
studio cross-over. Br J Nutr 2009; 102: 1065-1074
[PMID: 19402938 DOI: 10.1017/ S0007114509359127]
333 Trovato A, Nuhlicek DN, Midtling JE. Interazioni farmaco-nutrienti
Am Fam Physician 1991; 44: 1651-1658 [PMID: 1950962]
Chiudi fisarmonica
Le informazioni qui riportate su "Supplementi nutraceutici, nutrizione: e trattamento dell'ipertensione" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale