Molti professionisti sanitari raccomandano fortemente ai pazienti con sclerosi multipla, o SM, evitare i latticini. Diversi studi di ricerca hanno dimostrato un'elevata correlazione tra SM e latticini, in particolare il latte vaccino. Ad esempio, alcune delle proteine nel latte vaccino sono prese di mira dalle cellule immunitarie dei pazienti con sclerosi multipla. Questi includono butirofilina e albumina sierica bovina o BSA. Inoltre, l'iniezione di quelle stesse proteine del latte vaccino in animali da laboratorio ha causato la comparsa di lesioni nel loro sistema nervoso centrale.
Alcune proteine nel latte vaccino imitano parte della glicoproteina oligodendrocita della mielina, o MOG, la sezione della mielina che si ritiene innesca la reazione autoimmune associata alla sclerosi multipla. Inoltre, questo può indurre il sistema immunitario a iniziare un attacco al MOG, provocando successivamente la demielinizzazione. Un altro studio di ricerca che ha coinvolto più di 135,000 uomini e donne negli Stati Uniti ha determinato una connessione tra il latte vaccino e il disturbo neurologico degenerativo, il morbo di Parkinson. I ricercatori hanno ipotizzato che i prodotti lattiero-caseari, in particolare il latte vaccino, possano avere un effetto generalmente tossico sul tessuto nervoso.
L'intolleranza al lattosio è comune in tutta la popolazione generale ed è particolarmente frequente nelle popolazioni mediterranea, asiatica e africana. Le persone con intolleranza al lattosio sperimentano una varietà di sintomi, tra cui gonfiore, crampi, diarrea e nausea. Dati gli elevati rischi potenziali per le persone con SM che consumano prodotti lattiero-caseari, nonostante la mancanza di prove conclusive, gli operatori sanitari raccomandano di evitare il consumo di latticini, tra gli altri tipi di alimenti. Lo scopo di questo articolo è quello di discutere i fatti nutrizionali nella sclerosi multipla, compresi i tipi di alimenti che i pazienti con SM dovrebbero evitare, come i latticini.
Contenuti
Astratto
La questione se le abitudini alimentari e lo stile di vita abbiano influenza sul decorso della sclerosi multipla (SM) è ancora oggetto di discussione, e al momento la terapia con SM non è associata ad alcuna informazione sulla dieta e sullo stile di vita. Qui mostriamo che i fattori dietetici e lo stile di vita possono esacerbare o migliorare i sintomi della SM, modulando lo stato infiammatorio della malattia sia nella SM recidivante-remittente che nella SM primitiva-progressiva. Ciò si ottiene controllando sia le vie metaboliche che quelle infiammatorie nella cellula umana e la composizione del microbiota intestinale commensale. Ciò che aumenta l'infiammazione sono diete ipercaloriche di tipo occidentale, caratterizzate da sale alto, grasso animale, carne rossa, bevande zuccherate con zucchero, cibi fritti, fibre basse e mancanza di esercizio fisico. La persistenza di questo tipo di dieta sovraregistra il metabolismo delle cellule umane verso le vie biosintetiche comprese quelle delle molecole proinfiammatorie e porta anche a un microbiota intestinale disbiotico, alterazione dell'immunità intestinale e infiammazione sistemica di basso grado. Al contrario, l'esercizio e le diete ipocaloriche basate sull'assunzione di verdure, frutta, legumi, pesce, prebiotici e probiotici agiscono su recettori nucleari ed enzimi che sovrastimolano il metabolismo ossidativo, riducono la sintesi di molecole proinfiammatorie e ripristinano o mantengono un simbiotico sano microbiota intestinale. Ora che conosciamo i meccanismi molecolari con cui i fattori dietetici e l'esercizio fisico influenzano lo stato infiammatorio della SM, possiamo aspettarci che un intervento nutrizionale con cibo anti-infiammatorio e integratori alimentari possa alleviare i possibili effetti collaterali dei farmaci immunomodulatori e dei sintomi cronici sindrome da stanchezza e quindi favorire il benessere del paziente.
parole chiave: medicina alternativa complementare, microbiota intestinale, infiammazione, stile di vita, sclerosi multipla, alimentazione
Introduzione
La sclerosi multipla (SM) è una malattia cronica, infiammatoria e autoimmune del sistema nervoso centrale (SNC), che porta a una diffusa degradazione focale della guaina mielinica, lesioni assonali e neuronali variabili e disabilità nei giovani adulti, principalmente donne. La malattia è caratterizzata da processi infiammatori perivascolari disseminati ed eterogenei a livello della barriera ematoencefalica (BBB), con coinvolgimento di cellule T autoreattive, linfociti B, macrofagi e cellule microgliali contro la sostanza bianca del cervello e del midollo spinale (McFarland e Martin, 2007; Constantinescu e Gran, 2010; Kutzelnigg e Lassmann, 2014).
Anticorpi (Krumbholz et al., 2012), complemento attivato (Ingram et al., 2014), citochine, disfunzione mitocondriale (Su et al., 2009), specie reattive dell'ossigeno (ROS; Gilgun-Sherki et al., 2004), e le metalloproteinasi della matrice (MMPs, Liuzzi et al., 2002; Rossano et al., 2014) possono cooperare per produrre la patologia.
Dal punto di vista clinico, ci sono almeno due forme principali della malattia: la SM recidivante-remittente (RRMS, circa 85% dei casi clinici) e la SM primaria-progressiva (PPMS, circa 15% dei casi clinici) (Dutta e Trapp, 2014; Lublin et al., 2014). Nella RRMS, che di solito si evolve nella SM secondaria progressiva (SPMS), le recidive sono associate ad una maggiore infiammazione sistemica e formazione di lesioni nel cervello, seguite da remissioni più o meno complete, mentre la patogenesi della PPMS è caratterizzata da danni neurologici progressivi piuttosto che ricadute e remissioni.
Al momento esistono almeno terapie che modificano la malattia 10 che sono state trovate per rallentare la progressione della malattia e prevenire alcuni sintomi di disabilità, ma solo nel caso della RRMS. Tuttavia, poiché la malattia è complessa in natura e unica nel decorso individuale, nessun paziente risponde alla terapia nello stesso modo (Loleit et al., 2014). Allo stesso modo, non ci sono biomarcatori veramente affidabili che consentano a tutti di valutare l'efficacia del trattamento ed è quindi importante scoprire nuovi marcatori della malattia (Fernandez et al., 2014).
La mancanza di risposta alle terapie immunomodulatorie nel caso di PPMS, altrimenti efficace nel trattamento della RRMS, può essere dovuta a diversi meccanismi patogenici che agiscono in RRMS e PPMS. Tuttavia, questo non è vero per quanto riguarda l'infiammazione: una significativa associazione tra infiammazione e neurodegenerazione è stata osservata nel cervello non solo nella SM acuta e recidivante, ma anche nella SM progressiva secondaria e primaria (Frischer et al., 2009; Lassmann, 2013) e le lesioni attive della SM sono sempre associate all'infiammazione (Kutzelnigg e Lassmann, 2014). Pertanto, l'infiammazione deve essere l'obiettivo per il trattamento di entrambe le forme della malattia.
Collegare l'infiammazione con abitudini alimentari e stile di vita
Che cosa causa i processi infiammatori nella SM? La SM è una malattia complessa e le componenti genetiche e immunologiche non sono sufficienti a spiegare la sua origine. In realtà, la SM ha una natura multifattoriale e vari fattori ambientali o condizioni metaboliche possono avere un ruolo nel suo sviluppo (Ascherio, 2013): infezioni virali (Ascherio et al., 2012; Venkatesan e Johnson, 2014), avvelenamento da metalli pesanti (Latronico et al., 2013; Zanella e Roberti di Sarsina, 2013), fumo (Jafari e Hintzen, 2011), obesità infantile (Munger, 2013), basso stato di vitamina D (Ascherio et al., 2014), o stile di vita scorretto, incluso sbagliato abitudini alimentari (Riccio, 2011; Riccio et al., 2011; Riccio e Rossano, 2013).
Nessuno dei fattori ambientali sopra menzionati da solo può spiegare la malattia; tuttavia, le seguenti considerazioni rendono più attraente il coinvolgimento nella SM delle abitudini alimentari e dello stile di vita, piuttosto che infezioni o fumo, come fattori che possono influenzare il decorso della malattia:
- Distribuzione geografica: La SM è più diffusa nei paesi occidentali con il reddito più elevato e la più lontana dell'equatore. Le caratteristiche di questi paesi sono uno stile di vita sedentario, una dieta ipercalorica ricca di grassi saturi di origine animale (dieta occidentale) e bassa esposizione solare (WHO e MSIF, 2008).
- Effetto della migrazione: Con la migrazione da un'area ad alta incidenza di SM in un altro luogo con bassa incidenza prima dell'età di 15 anni, il basso rischio viene acquisito, mentre la migrazione dopo questa età non modifica il livello di rischio. Questo aspetto può essere collegato a fattori nutrizionali, piuttosto che a fattori ambientali infettivi o tossicologici (McLeod et al., 2011).
- Scarsa disponibilità di vitamina D: Un altro fattore ambientale legato alla dieta e alla distribuzione geografica è la disponibilità di vitamina D, che è più bassa alle latitudini con una minore esposizione alla luce solare. I pazienti con SM hanno un basso contenuto di vitamina D (Ascherio et al., 2014), ma questo vale anche per altre malattie infiammatorie croniche (Yin e Agrawal, 2014).
- Infiammazione postprandiale: L'alta percentuale di grassi animali / zuccheri alti e carboidrati raffinati è associata all'infiammazione postprandiale (Erridge et al., 2007; Ghanim et al., 2009; Margioris, 2009).
- Alto indice di massa corporea: Un indice di massa corporea (BMI) elevato prima dei 20 anni è associato a un rischio maggiore di 2 (Hedstr m et al., 2012). Si noti che il BMI è correlato con lo stato del microbiota intestinale.
- Somiglianza con altre malattie infiammatorie legate a abitudini alimentari sbagliate: La SM ha alcune somiglianze con la malattia infiammatoria intestinale (IBD, Cantorna, 2012): entrambi hanno una bassa vitamina D e sono influenzati da fattori ambientali (Dam et al., 2013). Inoltre, il glatiramer acetato (GA, o Copolymer 1 / Copaxone) è benefico in entrambe le malattie (Aharoni, 2013) e vi è un'aumentata incidenza di IBD tra i pazienti con SM.
Come il cibo influenza il decorso delle malattie infiammatorie: un approccio di base
Le osservazioni riportate sopra suggeriscono che lo stato nutrizionale può influenzare il decorso della SM. Tuttavia, sorge la domanda su come le molecole alimentari potrebbero esacerbare o migliorare i sintomi della SM, e in generale come potrebbero favorire o downregolare l'infiammazione a livello molecolare. In particolare, è importante chiarire quali sono gli obiettivi delle molecole dietetiche e dei meccanismi molecolari coinvolti, se ve ne sono.
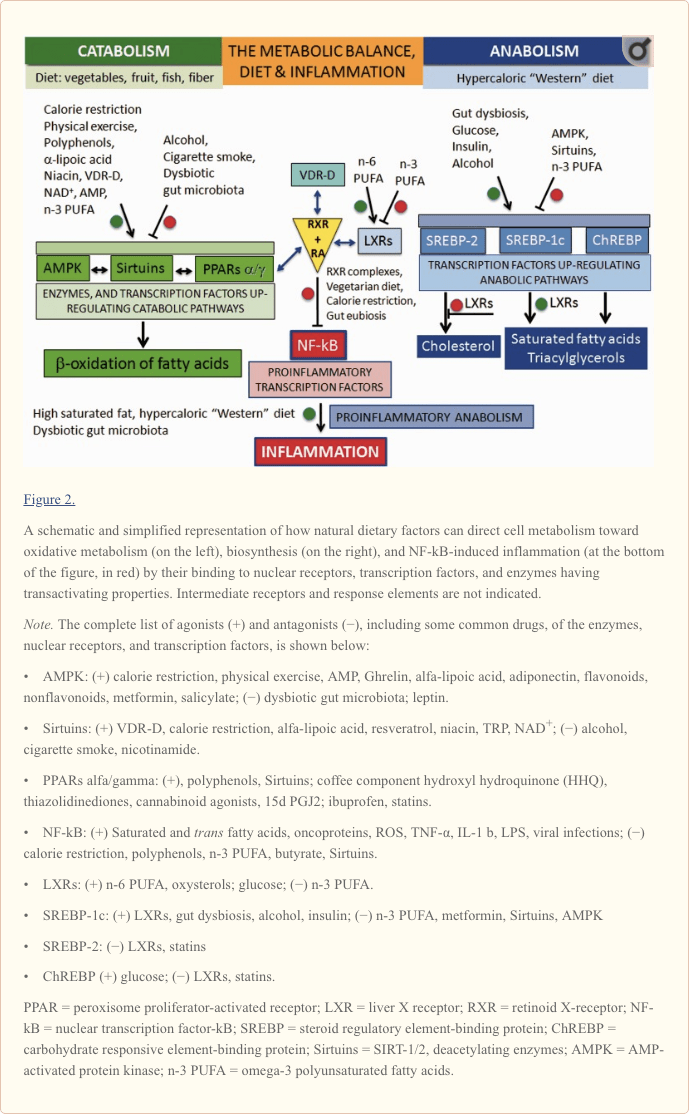
Fondamentalmente, possiamo dire che il cibo che consumiamo ha un ampio impatto sul nostro sviluppo, comportamento, condizioni di salute e durata della vita agendo su due obiettivi principali: (A) le cellule del nostro corpo e (B) il microbiota intestinale commensale (Figura 1).
- Da un lato, diversi tipi e quantità di fattori dietetici possono interagire con enzimi, fattori di trascrizione e recettori nucleari di cellule umane. Questo può indurre modificazioni specifiche del metabolismo cellulare verso il catabolismo o l'anabolismo e modulare le risposte infiammatorie e autoimmuni nel nostro corpo (Desvergne et al., 2006).
- D'altra parte, dobbiamo considerare l'impatto della dieta e dello stile di vita sulla nostra microflora intestinale. Siamo infatti metaorganismi che vivono con migliaia di miliardi (1014) di cellule microbiche (approssimativamente 10 volte le cellule del nostro corpo) e migliaia di microrganismi diversi conosciuti come il microbiota intestinale. Questo complesso ecosistema è una parte essenziale del nostro organismo e influenza sia il nostro sistema immunitario che il nostro metabolismo. Pertanto, ha un forte impatto sulla nostra salute.

Nella salute, esiste una stretta relazione mutualistica e simbiotica tra il microbiota intestinale e gli esseri umani, e il microbiota intestinale fornisce una serie di utili funzioni metaboliche, protegge contro gli enteropatogeni e contribuisce alle normali funzioni immunitarie. Questo è lo stato normale del microbiota intestinale umano, chiamato eubiosi. La distorsione da eubiosi, legata a una diminuzione della biodiversità intestinale e all'aumento di batteri patogeni, è chiamata disbiosi. La conseguenza più comune di un microbiota intestinale disbiotico è l'alterazione del sistema immunitario della mucosa e l'insorgenza di malattie infiammatorie, immunitarie, metaboliche o degenerative (Chassaing e Gewirtz, 2014).
Diversi tipi e quantità di fattori dietetici stimolano la selezione di specifiche popolazioni microbiche intestinali che cambiano tipo e numero di specie microbiche verso eubiosi o disbiosi, semplicemente agendo attraverso l'alimentazione preferenziale di una o dell'altra popolazione microbica. Se la nostra dieta favorisce il passaggio a un microbiota intestinale disbiotico, questo può portare a infiammazione intestinale, alterazione dell'immunità intestinale e quindi a infiammazione sistemica e malattie infiammatorie croniche.
In che modo i fattori dietetici influenzano il metabolismo delle cellule umane e modulano l'infiammazione
Per capire in che modo le molecole alimentari possono influenzare direttamente il metabolismo delle cellule umane, è necessario descrivere prima quali sono gli enzimi e i fattori di trascrizione coinvolti nel catabolismo o anabolismo nella cellula.
Come mostrato a sinistra nella Figura 2, il metabolismo ossidativo è sovraregolato da due enzimi e un recettore nucleare. Gli enzimi sono la chinasi della proteina attivata da AMP (AMPK; Steinberg e Kemp, 2009) e la Sirtuins (SIRT), un gruppo di istoni deacilanti dell'istone, attivati dal NAD + (Zhang et al., 2011; Rice et al., 2012). Il recettore nucleare è rappresentato dagli isotipi dei recettori attivati dal proliferatore del perossisoma (PPARs, Desvergne e Wahli, 1999; Burns e VandenHeuvel, 2007).
ï ¿½
Gli isotipi PPAR sovraregolano la trascrizione dei geni coinvolti nella beta-ossidazione degli acidi grassi nei mitocondri e nei perossisomi e formano una rete con le vie AMPK e Sirtuins. Il pathway AMPK-Sirtuins-PPAR è attivato da uno stile di vita basato sulla restrizione calorica e sull'esercizio fisico, nonché da alcune molecole bioattive (polifenoli, presenti in frutta e verdura e grassi polinsaturi a catena lunga omega-3 (n-3) acidi [PUFA], presenti nei pesci). Gli isotipi PPAR attivati dal ligando formano complessi eterodimerici con il recettore X del retinoide (RXR), che a sua volta viene attivato dall'acido 9-cis-retinoico (RA).
Al contrario, come mostrato a destra nella Figura 2 come sull'altro piatto di un equilibrio immaginario un elevato apporto di nutrienti densi di energia porta alla sovraregolazione dell'anabolismo, inclusa la lipogenesi e la crescita cellulare, attraverso l'attivazione dell'elemento regolatore degli steroli- proteine leganti, SREBP-1c e SREBP-2 (Xu et al., 2013) e la proteina legante gli elementi reattivi ai carboidrati, ChREBP (Xu et al., 2013). SREBP-1c e SREBP-2 sono sotto il controllo dei recettori nucleari chiamati recettori X del fegato (LXR; Mitro et al., 2007; Nelissen et al., 2012). Gli isotipi LXR, attivati dai derivati del colesterolo ossisteroli e glucosio, hanno un ruolo rilevante nella sintesi dei lipidi attivando SREBP-1c e la sintesi dei triacilgliceroli, inibendo allo stesso tempo SREBP-2 e la sintesi del colesterolo.
Al centro della comprensione del legame tra dieta e infiammazione sono due fattori di trascrizione coinvolti nell'infiammazione e nell'autoimmunità: il fattore di trascrizione nucleare-kB (NF-kB) e la proteina attivatrice (AP-1; Yan e Greer, 2008). Nella SM, sia NF-kB che AP-1 sono attivati e inducono l'espressione di diversi geni proinfiammatori e la produzione di molecole proinfiammatorie. La causa della loro attivazione nella SM non è nota ma, come mostrato nella Figura 2 per NF-kB, questo può essere attivato non solo da virus, citochine e stress ossidativo ma anche da alcuni componenti dietetici come acidi grassi saturi o trans insaturi acidi grassi, che quindi possono essere considerati proinfiammatori.
La sottoregolazione dell'NF-kB proinfiammatorio può essere ottenuta mediante il legame inibitorio delle forme attivate da RA degli isotipi del recettore X dei retinoidi (RXRs; Pèrez et al., 2012; Zhao et al., 2012; Fragoso et al. , 2014).
Come mostrato nel centro della Figura 2 e più in dettaglio nella Figura 3, le forme attive di RA-RXR sono eterodimeri derivanti dalla loro associazione con specifici recettori nucleari attivati dal ligando, vale a dire PPARs, LXRs e recettore della vitamina D (VDR).
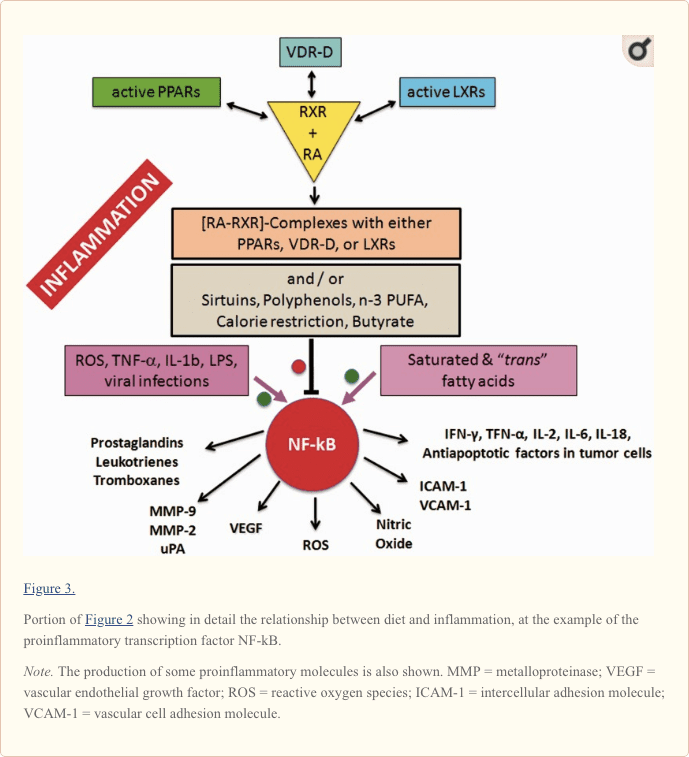
Tutti e tre i recettori nucleari (PPAR, LXR e VDR) devono essere attivati da ligandi specifici. Come indicato nella Figura 2, i ligandi possono essere fattori dietetici specifici e questo chiarisce come le cellule rispondono ai cambiamenti dello stato nutrizionale e regolano l'omeostasi energetica ma rappresenta anche la chiave molecolare per capire come i nutrienti possono influenzare il decorso delle malattie infiammatorie croniche (Heneka et al. ., 2007; Zhang-Gandhi e Drew, 2007; Krishnan e Feldman, 2010; Cui et al., 2011; Schnegg e Robbins, 2011; Gray et al., 2012).
Pertanto, ciascuno dei tre recettori nucleari PPAR, LXR e VDR compete per il legame con RA-RXR e forma eterocomplessi che possono inibire NF-kB ed esercitare uno stretto controllo sull'espressione dei geni infiammatori, integrando così il metabolismo e segnalazione infiammatoria. È chiaro che c'è competizione tra i tre recettori PPAR, LXR e VDR-D, per il legame con RA-RXR, ma questa competizione dovrebbe avere un'influenza solo sul metabolismo e non sull'infiammazione, perché non si sa ancora quale dei tre eterodimeri è più efficace nell'inibire NF-kB.
Ovviamente, la produzione di molecole proinfiammatorie nel corso delle recidive è un processo biosintetico: è sostenuta da diete ipercaloriche e contrastata da diete ipocaloriche. In linea di principio, ciò che favorisce l'anabolismo promuoverà i processi infiammatori, mentre quello che favorisce il catabolismo li contrasterà (Figura 4).

In che modo i fattori dietetici influenzano la composizione e la biodiversità del microbiota intestinale e dell'ospite alterato
Il legame tra stile di vita, abitudini alimentari e composizione microbiota intestinale
La composizione della microflora intestinale è altamente individuale ed è influenzata da molti fattori come la dieta, l'attività fisica, lo stress, i farmaci, l'età e così via. Ognuno di noi ha un insieme unico di specie di batteri 100 o 150.
Un modo semplice per discutere degli effetti del cibo e dello stile di vita sulla microflora intestinale è limitare la panoramica a due sole divisioni batteriche dominanti, i Bacteroidetes e i Firmicutes, che rappresentano circa il 90% del totale, poiché è stato dimostrato che il rapporto Bacteroidetes / Firmicutes (B / F) è influenzato dalle abitudini alimentari a lungo termine (Cani e Delzenne, 2009; Wu et al., 2011; Lozupone et al., 2012; Tremaroli e Böckhed, 2012; Panda et al., 2014).
Uno studio comparativo di De Filippo et al. (2010) nei bambini di Firenze e del Burkina Faso in Africa ha dimostrato che le abitudini alimentari a lungo termine hanno effetti significativi sul microbiota intestinale umano.
In questo studio, la dieta del Burkina Faso era basata sul consumo di polisaccaridi vegetali come il miglio e il sorgo (10 g di fibre / giorno e 662 kcal / giorno), mentre la dieta dei bambini italiani era di tipo occidentale, a base di proteine, grassi animali, bevande zuccherate e carboidrati raffinati (992 g di fibre / giorno e 5.6-1,068 kcal / giorno). L'analisi dei campioni fecali nei bambini africani ha mostrato la prevalenza di Bacteroidetes (1,512%), principalmente Prevotella e Xylanibacter, e bassi livelli di Firmicutes (73%). Al contrario, nei bambini italiani è stata osservata una prevalenza di Firmicutes (12%) sui Bacteroidetes (51%), ma i Bacteroidetes sono passati da Prevotella e Xylanibacter a Bacteroides. Questi ultimi sono solitamente selezionati tra i Bacteroidetes perché possono utilizzare anche zuccheri semplici oltre ai glicani complessi, e gli zuccheri semplici sono normali componenti delle diete occidentali.
In conclusione, il rapporto B / F aumenta in associazione con una dieta ricca di carboidrati complessi (non digeribili dai nostri enzimi) perché i batteri simbionti e solitamente non nocivi, come i batteri Prevotella e Xylani, amano avere glicani complessi da mangiare. I batteri che consumano glicani complessi producono butirrato, che regola verso il basso l'attivazione di NF-kB proinfiammatorio (Figura 3).
Viceversa, le diete occidentali ad alta densità energetica modificano il profilo del microbiota intestinale e aumentano la popolazione di Firmicutes (inclusi i Mollicutes), più adatti per estrarre e raccogliere energia, ma spesso patogeni (Moschen et al., 2012).
Il legame tra microbiota intestinale disbiotica e infiammazione cronica
In un microbiota intestinale disbiotico, il rapporto B / F è basso e i Firmicutes possibilmente patogeni prevalgono su Bacteroidetes (Figura 5). Il fallimento dell'equilibrio microbico e la diminuzione della biodiversità che si verifica nella disbiosi portano all'interruzione della complessa interazione tra il microbiota e il suo ospite e contribuiscono all'endotossemia di basso grado e all'infiammazione cronica intestinale e sistemica. Con l'inizio dell'infiammazione sistemica, aumenta il rischio di malattie infiammatorie croniche e immuno-mediate (Tilg et al., 2009; Brown et al., 2012; Maynard et al., 2012).

In realtà, in presenza di un microbiota disbiotico, l'endotossina intestinale / lipopolisaccaride (LPS) è aumentata, le cellule T regolatorie (Treg) sono difettose, e i recettori arilici idrocarburici e le cellule Th17 proinfiammatorie sono attivate (Cani et al., 2008; Veldhoen et al., 2008).
LPS porta alla disfunzione della barriera mucosa e colpisce altri tessuti quando il suo livello plasmatico aumenta al di sopra del siero 200 pg / ml. L'aumentata permeabilità intestinale dovuta al microbiota intestinale disbiotico può essere esemplificata dal passaggio di anticorpi IgA e IgG contro glutine e gliadina, osservati anche in pazienti con SM (Reichelt e Jensen, 2004).
Il collegamento tra il microbiota intestinale disbiotico e la sclerosi multipla
Nel nostro lavoro precedente, abbiamo proposto che il modello che collega l'alterazione del microbiota, dovuto alla dieta e allo stile di vita occidentali, e il fallimento della corretta comunicazione tra il microbiota e l'intestino, che porta a endotossiemia di basso grado e infiammazione autoimmune sistemica, potrebbe essere valido anche per la patogenesi della SM (Fernèndez et al., 2012; Riccio, 2011). Infatti, la SM condivide con altre malattie infiammatorie croniche meccanismi comuni, tutti probabilmente basati sulla persistenza di endotossiemia di basso grado correlata a stili di vita e abitudini alimentari sbagliate insieme a una disbiosi latente. Inoltre, l'esistenza di un asse microbiota intestinale-cervello, che ora è più di un concetto emergente, suggerisce che l'intervento sul microbiota intestinale potrebbe essere una strategia fruttuosa per il trattamento futuro di disturbi complessi del SNC (Cryan e Dinan, 2012).
Il possibile legame diretto tra microbiota intestinale e SM è stato dimostrato sperimentalmente da Berer et al. (2011). Utilizzando topi transgenici, Berer et al. hanno dimostrato che i batteri intestinali possono scatenare una malattia autoimmune recidivante-remittente guidata da cellule T CD4 + specifiche della mielina e demielinizzazione, data la disponibilità di MOG, l'autoantigene della glicoproteina oligodendrocita della mielina. In un altro studio, è stato dimostrato che il trattamento antibiotico diretto ad alterare la microflora intestinale sopprime l'encefalomielite allergica sperimentale (EAE; Yokote et al., 2008).
Questi risultati suggeriscono che il microbiota intestinale può giocare un ruolo cruciale nella fase iniziale della SM e può anche predisporre la suscettibilità dell'ospite ad altre malattie autoimmuni del SNC così come a disturbi neuropsichiatrici quali autismo, depressione, ansia e stress. Sta emergendo un nuovo concetto di asse del microbiota-cervello intestinale (Wang e Kasper, 2014).
Su queste basi, la comprensione del ruolo del microbiota intestinale nella salute e nella malattia può gettare le basi per trattare le malattie croniche modificando la composizione del microbiota intestinale attraverso la scelta di uno stile di vita corretto, comprese le abitudini alimentari. Inoltre, la manipolazione diretta del microbiota intestinale può migliorare la risposta immunitaria adattativa e ridurre le secrezioni infiammatorie. Ad esempio, poiché un ruolo specifico delle cellule Th17 intestinali è stato suggerito nell'immunopatologia della SM (Sie et al., 2014), la promozione del differenziamento delle cellule Treg e la riduzione delle cellule patogene di Th17 potrebbero prevenire la recidiva dell'autoimmunità nei pazienti con SM (Issazadeh-Navikas et al. , 2012).
Per questi motivi, la scoperta che il difetto del bilancio Treg / Th17 osservato nei modelli MS è presente anche nei pazienti con SM, potrebbe avere importanti implicazioni cliniche, poiché questo difetto può essere modulato dai cambiamenti nella composizione del microbiota, che a sua volta è modulato da cambiamenti dietetici (David et al., 2014).
Fattori dietetici proinfiammatori
I componenti della dieta il cui apporto deve essere controllato per evitare l'aumento dei processi infiammatori nella SM, così come in altre malattie infiammatorie croniche, sono i seguenti:
- Acidi grassi saturi di origine animale;
- Acidi grassi insaturi nella configurazione trans (acidi grassi idrogenati);
- Carne rossa;
- Bevande zuccherate e in generale diete ipercaloriche ricche di carboidrati raffinati (a basso contenuto di fibre), oltre al grasso animale;
- Aumento dell'assunzione di sale nella dieta;
- Proteine del latte vaccino della membrana del globulo di grasso del latte (proteine MFGM).
Grasso di origine animale
Gli acidi grassi saturi di origine animale, che si trovano in alimenti come latte intero, burro, formaggio, carne e salsicce, sono i componenti della dieta presi in considerazione più frequentemente per la loro influenza deleterio sul corso della SM.
In 1950, Swank ha suggerito che il consumo di grassi animali saturi è direttamente correlato con la frequenza della SM, ma un legame tra l'assunzione limitata di grasso animale e la remissione della SM è stato segnalato solo in 2003 (Swank e Goodwin, 2003). Secondo Swank e Goodwin, le diete ad alto contenuto di grassi portano alla sintesi di lipidi di stoccaggio e colesterolo e causano una diminuzione della fluidità della membrana e una possibile ostruzione dei capillari e l'insorgenza o l'aumento dell'infiammazione.
Altri studi più recenti indicano che l'azione del grasso saturo è controllata a livello trascrizionale e influenza sia l'espressione genica, il metabolismo cellulare, lo sviluppo e la differenziazione delle cellule. Più in generale, l'assunzione di grasso animale è spesso legata a un apporto calorico elevato, che è di per sé un fattore dannoso per molte malattie infiammatorie croniche. Infine, come descritto più avanti in questo articolo, un eccesso di grasso animale saturo porta a un microbiota intestinale disbiotico, disfunzione dell'immunità intestinale e infiammazione sistemica di basso grado e rappresenta una possibile causa di alcuni disturbi cronici umani.
Acidi grassi trans
Gli acidi grassi trans (TFA) sono acidi grassi insaturi che contengono almeno un doppio legame non coniugato nella configurazione trans (Bhardwaj et al., 2011).
Come prodotti di idrogenazione parziale di oli vegetali, sono stati introdotti negli 1960 per sostituire il grasso animale, ma solo molto tempo dopo si è scoperto che hanno lo stesso effetto deleterio sul metabolismo e, come gli acidi grassi saturi, aumentano i livelli di colesterolo e promuovere la formazione di grasso addominale e aumento di peso. L'assunzione di TFA è risultata essere positivamente associata all'infiammazione intestinale e alla sovraregolazione delle citochine proinfiammatorie nella polarizzazione delle cellule di Th17 (Okada et al., 2013). Inoltre, i TFA interferiscono con il metabolismo degli acidi grassi insaturi naturali, che hanno la configurazione cis.
I TFA si trovano nella margarina e in altri grassi vegetali (idrogenati) trattati, nella carne e nei prodotti dietetici dei ruminanti e negli snack. Possono essere presenti anche in patatine fritte e altri cibi fritti, in quanto si formano anche nella frittura.
Carne rossa
La carne rossa contiene più ferro eme rispetto alla carne bianca. Il ferro è facilmente nitrosilato e questo facilita la formazione di nitroso-composti endogeni (NOCs; Joosen et al., 2010). L'assunzione di carne rossa mostra infatti una relazione dose-risposta con la formazione di NOC, mentre non esiste tale relazione per la carne bianca. I NOC sono mutageni: inducono nitrosilazione e danno al DNA. La carne rossa lavorata (conservata con nitrito) aumenta il rischio. Le ammine eterocicliche si formano durante la cottura della carne ad alte temperature, ma questo non è specifico per la carne rossa (Joosen et al., 2010).
Depositi anormali di ferro sono stati trovati nei siti di infiammazione nella SM (Williams et al., 2012) e il consumo di carne rossa è associato a livelli più elevati di? -GT e hs-CRP (Montonen et al., 2013).
Degno di nota, non abbiamo acido N-glicolilneuraminico (Neu5Gc), un acido sialico importante, perché una mutazione inattivante nel gene CMAH ha eliminato la sua espressione nell'uomo. L'incorporazione metabolica di Neu5Gc da fonti alimentari - in particolare carne rossa e latticini - può creare problemi, poiché gli esseri umani hanno anticorpi anti-Neu5Gc circolanti e questo implica la possibile associazione con l'infiammazione cronica (Padler-Karavani et al., 2008).
Infine, la carne contiene acido arachidonico (il PUFA omega-6 (n-6), che è il precursore degli eicosanoidi proinfiammatori [prostaglandine, trombossani e leucotrieni]) e attiva la via Th17 (Stenson, 2014).
Elevata assunzione di zucchero e bassa assunzione di fibre
L'elevato consumo di bevande zuccherate e cereali raffinati, con basso contenuto di fibre, aumenta rapidamente il numero di calorie e il livello di glucosio. Il successivo aumento della produzione di insulina sovraregolamenta le vie biosintetiche e inter alia la produzione di acido arachidonico e dei suoi derivati proinfiammatori.
Aumento di assunzione di sale dietetico
L'aumento dell'assunzione di sale nella dieta potrebbe essere un fattore di rischio ambientale per lo sviluppo di malattie autoimmuni, poiché è stato dimostrato che può indurre cellule patogene Th17 e relative citochine proinfiammatorie in EAE (Kleinewietfeld et al., 2013; Wu et al., 2013) . Le cellule Th17 sono state coinvolte nello sviluppo della SM.
Grasso di latte vaccino e proteine della membrana globulare di grasso di latte
Il grasso del latte viene disperso in modo omogeneo e protetto dall'ossidazione, grazie ad una membrana composta da lipidi e particolari proteine chiamate proteine della membrana del globulo di grasso del latte (MFGM; Riccio, 2004). Queste proteine, che rappresentano solo l'1% delle proteine del latte, hanno un valore informativo piuttosto che nutritivo. Nella lattazione umana, sono necessari per la corretta formazione dei sistemi digestivo, nervoso e immunitario nei neonati. Questo flusso di informazioni non è ovviamente rilevante, o non è affatto richiesto, in età adulta e, anche, nel caso del latte vaccino assunto per l'alimentazione umana. In età adulta, le proteine MFGM del latte vaccino non hanno più un ruolo informativo e possono essere eliminate dalla dieta insieme al grasso del latte.
La rimozione delle proteine MFGM dal latte vaccino intero è particolarmente rilevante nel caso della SM. La proteina MFGM più rappresentativa (40% delle proteine MFGM totali), la butirofilina (BTN), è infatti sospettata di avere un ruolo nella SM, in quanto è molto simile a MOG, uno degli autoantigeni candidati nella SM. BTN e MOG condividono lo stesso comportamento nei modelli sperimentali sulla SM e gli anticorpi cross-reattivi MOG / BTN sono stati trovati nella SM, nell'autismo e nella malattia coronarica (CHD; Riccio, 2004). Per questi motivi, il paziente con SM dovrebbe evitare l'assunzione di latte vaccino intero e preferire il latte scremato, che, inoltre, non ha grasso animale.
Un altro punto di vista è quello di Swanson et al. (2013). Hanno scoperto che le molecole di tipo BTN o BTN potrebbero avere un ruolo regolatore nell'immunità e quindi suggeriscono che le molecole di tipo BTN o BTN potrebbero essere utili per indurre lo sviluppo di Treg.
Diete ipercaloriche e infiammazione post-prandiale
Dopo ogni pasto, potremmo sperimentare uno stress ossidativo transitorio e moderato e una moderata risposta infiammatoria a seconda del tipo e della quantità di cibo. Le abitudini alimentari basate su un'esposizione frequente e persistente a pasti con alta assunzione di sale / grassi animali e bevande trans-zucchero / zuccherate stressano il nostro sistema immunitario / metabolico e il conseguente possibile fallimento dell'omeostasi può portare a disordini immunitari e metabolici di varia natura .
Presi insieme, lo stress dipendente dalla dieta potrebbe essere dovuto ai seguenti motivi: (a) apporto calorico: più alte sono le calorie, più lo stress ossidativo indotto; (b) carico glicemico di un pasto: picchi glicemici postprandiali acuti possono indurre un rilascio di insulina molto più alto del necessario; (c) schema lipidico: grasso animale saturo, acidi grassi trans e omega-6 (n-6) PUFA a catena lunga favoriscono l'infiammazione postprandiale. Come riportato nelle sezioni seguenti, l'infiammazione postprandiale è attenuata o soppressa da n-3 PUFA e polifenoli, restrizione calorica ed esercizio fisico.
Composti bioattivi naturali antinfiammatori: utili per combattere la SM e prevenire le recidive?
Specifiche molecole dietetiche bioattive sono in grado di contrastare gli effetti degli agenti patogeni microbici e di ridurre l'espressione delle molecole infiammatorie. Tra questi, i composti più importanti sono i polifenoli e i carotenoidi delle verdure, il n-3 PUFA dei pesci, le vitamine D e A, i composti tiolici come l'acido lipoico e gli oligoelementi come il selenio e il magnesio.
La maggior parte dei composti sopra menzionati, ad eccezione del PUFA, che non sono antiossidanti, sono noti per le loro proprietà antiossidanti. La motivazione per l'uso di antiossidanti nella SM si basa sull'osservazione che lo stress ossidativo è una delle componenti più importanti del processo infiammatorio che porta alla degradazione della mielina e al danno assonale. Tuttavia, è ormai noto che gli antiossidanti alimentari hanno proprietà biologiche aggiuntive che vanno ben oltre la semplice attività antiossidante. Infatti, sono in grado di contrastare gli effetti negativi degli agenti microbici e degli acidi grassi saturi o trans, sottoregolando l'espressione delle molecole proinfiammatorie, dello stress ossidativo e dell'angiogenesi.
Polifenoli
Tutti i polifenoli (presenti in verdure, cereali, legumi, spezie, erbe aromatiche, frutta, vino, succhi di frutta, tè e caffè) hanno proprietà antinfiammatorie, immunomodulatrici, anti-angiogeniche e antivirali e stimolano le vie cataboliche (Gupta et al., 2014; Wang et al., 2014). Si trovano nelle piante sotto forma di glicosidi, esteri o polimeri, troppo grandi per entrare nella membrana intestinale. Gli agliconi rilasciati dal microbiota intestinale sono coniugati a glucuronidi e solfati nell'intestino e nel fegato. La loro solubilità e biodisponibilità sono molto scarse ( M; Visioli et al., 2011).
Da un punto di vista strutturale, i polifenoli includono flavonoidi e molecole di non flavonoidi (Bravo, 1998). I flavonoidi più importanti sono la quercetina (cipolle, mele, agrumi e vino, Min et al., 2007; Sternberg et al., 2008), catechine (tè verde; Friedman, 2007) e daidzeina e genisteina (soia; et al., 2013; Zhou et al., 2014). I non-flavonoidi più importanti sono il resveratrolo (cioccolato, arachidi, bacche, uva nera e vino rosso; Das e Das, 2007; Cheng et al., 2009; Shakibaei et al., 2009), curcumina (spezia curcuma della famiglia di zenzero, curry ; Prasad et al., 2014) e idrossitirosolo (olio d'oliva; Hu et al., 2014).
È stato trovato che l'effetto antinfiammatorio dei polifenoli in vitro può dipendere dalla loro struttura chimica (Liuzzi et al., 2011). Pertanto, una miscela di flavonoidi e non-flavonoidi può essere più efficace della supplementazione con un solo polifenolo.
Due esempi dei polifenoli più studiati sono la quercetina e il resveratrolo. La quercetina è presente principalmente come glucoside. La maggior parte dei suoi effetti sono additivi a quelli dell'interferone- ?. La quercetina non è tossica, ma il suo prodotto di ossidazione, la quercetina chinone, è molto reattivo verso i gruppi SH delle proteine e del glutatione e può essere tossico (Boots et al., 2008). L'aggiunta di acido lipoico o N-acetilcisteina può limitare gli effetti tossici.
Il resveratrolo è glucuronato nel fegato e assorbito in questa forma principalmente nel duodeno ma solo in quantità molto limitate. A seconda della sua concentrazione, il resveratrolo può indurre la morte di un'ampia varietà di cellule per necrosi o apoptosi. A questo proposito, è comunemente accettato che il resveratrolo abbia effetti neuroprotettivi; tuttavia, è stato anche riportato che può esacerbare malattie sperimentali simili alla SM (Sato et al., 2013). Queste discrepanze possono essere attribuite alle diverse concentrazioni utilizzate in vitro o biodisponibili in vivo, poiché il resveratrolo ha effetti opposti a concentrazioni di 10 ± 5 M (proliferazione di cellule mesenchimali umane) e 10 ± 4 M (inibizione della proliferazione). Nella nostra esperienza, il resveratrolo ha un effetto neurotrofico sui neuroni corticali in coltura solo a concentrazioni molto basse, mentre a concentrazioni più elevate può avere effetti tossici. Ma in caso di stress ossidativo, il resveratrolo ha proprietà neuroprotettive anche alle concentrazioni più elevate.
Vitamina D, vitamina A, carotenoidi, altre vitamine e oligoelementi
Altri composti e elementi che possono essere utili come integratori nella SM sono le vitamine D, A, E, C, B12 (Mastronardi et al., 2004) e niacina (Penberthy e Tsunoda, 2009) e oligoelementi come il selenio (Boosalis , 2008) e magnesio (Galland, 2010).
La vitamina D ha ruoli immuno-modulatori e rappresenta la molecola più promettente nella dieta per il trattamento di malattie infiammatorie croniche come la SM (Smolders et al., 2008; Pierrot-Deseilligny, 2009; Cantorna, 2012; Ascherio et al., 2014). Come già accennato, si ritiene generalmente che la distribuzione geografica speciale della SM nel mondo possa essere attribuita anche alla ridotta disponibilità di vitamina D3, a causa di una insufficiente esposizione alla luce solare in alcuni paesi, e la mancanza di vitamina D attiva potrebbe essere un'altra possibile causa di origine ambientale della SM. Tuttavia, bassi livelli di vitamina D attiva possono essere dovuti anche al suo metabolismo alterato o funzione non solo per l'esposizione alla luce solare. In effetti, il fallimento della supplementazione di vitamina D3 (colecalciferolo) per mostrare effetti benefici sul peso corporeo o sul decorso di malattie infiammatorie può essere dovuto alla persistenza della sua carenza nonostante la sua somministrazione.
La vitamina D3 (colecalciferolo), formata dopo l'esposizione alla luce solare, viene idrossilata nel fegato a 25- (OH) D3 (calcidiolo) dagli enzimi P450 CYP27A1 o CYP2R1, e successivamente attivata nel rene dal CYP27B1 a 1 ?, 25- ( OH) 2 D3 (calcitriolo). Quest'ultima, la forma attiva della vitamina D, è inattivata dal CYP24A1 a 1 ?, 24,25- (OH) 3 D3 (acido calcitroico). Ciò significa che i livelli di vitamina D attiva dipendono dalle velocità relative della sua sintesi tramite CYP27B1 e dalle sue modifiche tramite CYP24A1 (Schuster, 2011). Un'elevata espressione di CYP24A1, indotta da composti endogeni e xenobiotici, potrebbe portare a bassi livelli di vitamina D e causare o aumentare malattie infiammatorie croniche e cancro. Per questi motivi, è importante monitorare il livello di vitamina D durante la somministrazione di vitamina D. Se i livelli di vitamina D rimangono bassi, l'espressione dell'mRNA di CYP24A1 dovrebbe essere esaminata e la determinazione delle attività di CYP27B1 e CYP24A1 e la loro inibizione dovrebbe essere testata (Chiellini et al., 2012, Ksa et al., 2013).
Un altro aspetto importante riguarda il VDR. Il metabolita attivo della vitamina D 1?, La 25-diidrossivitamina D si lega alla VDR e il complesso VDR-D controlla l'espressione di diversi geni coinvolti in processi di potenziale rilevanza per le malattie croniche. Come rappresentato nelle Figure 2 e e3,3, il complesso VDR-D compete con PPAR o LXR attivati da ligando per il legame con RA-RXR. I complessi eterodimerici si legano al fattore di trascrizione proinfiammatorio NFkB e sottoregolano la sintesi delle molecole proinfiammatorie. In questo contesto, quando si valuta l'efficacia della supplementazione di vitamina D nel corso della SM, si dovrebbero considerare gli eventuali polimorfismi che interessano la VDR, che è stata recentemente associata ad obesità, infiammazione e alterazioni della permeabilità intestinale (Al-Daghri et al. , 2014).
Inoltre, la scoperta che VDR-D attiva Sirtu SIRT-1 (An et al., 2010; Polidoro et al., 2013) suggerisce che la vitamina D ha un'influenza anche sul metabolismo cellulare e quindi può avere proprietà simili a quelle di molti altri integratori alimentari naturali: sovraregolano il metabolismo ossidativo e riducono l'infiammazione.
Infine, va considerato che ci sono differenze tra i dati negli esseri umani e i modelli sperimentali. In realtà, nell'uomo, a differenza dei topi, l'obesità è associata a uno scarso stato di vitamina D (Bouillon et al., 2014).
Tra i carotenoidi, il più importante è il licopene (pomodoro, anguria e rosa, Rao e Rao, 2007). Oltre ad essere un antiossidante molto potente, il licopene può dare beta-carotene e acido retinoico, e quest'ultimo può attivare il recettore RXR (Figura 2). Sebbene l'assunzione più elevata di carotenoidi, vitamina C e vitamina E non riducano il rischio di sclerosi multipla nelle donne (Zhang et al., 2001), la rilevanza del licopene e della vitamina A contro l'infiammazione non può essere ignorata.
Omega-3 (n-3) Acidi grassi essenziali e acidi grassi polinsaturi da verdure, frutti di mare e olio di pesce
n-3 acidi grassi essenziali (EFA) e PUFA rappresentano una valida alternativa agli acidi grassi saturi di origine animale.
Gli oli vegetali e vegetali contengono gli acidi grassi essenziali acido linoleico (n-6) e acido linolenico (n-3). Gli acidi grassi n-6 e n-3 hanno effetti opposti e la loro presenza nella dieta dovrebbe essere equivalente (Schmitz e Ecker, 2008). Tuttavia, nelle diete occidentali, il rapporto n-6 / n-3 aumenta da 6 a 15 e ciò porta a una maggiore incidenza di malattie cardiovascolari e infiammatorie. Infatti, l'acido linoleico porta alla formazione di acido arachidonico (20: 4), il precursore degli eicosanoidi proinfiammatori prostaglandine-2, leucotrieni-4 e trombossani-2. La sintesi di questi eicosanoidi è favorita dall'insulina e inibita dall'aspirina, così come dall'EPPA EFA a catena lunga n-3 (acido eicosapentaenoico) e DHA (acido docosaesaenoico), che derivano dall'acido linolenico n-3.
Sia il DHA che l'EPA si trovano nei frutti di mare e nell'olio di pesce. Entrambi mostrano notevoli attività antinfiammatorie, antitrombotiche e immunomodulatorie, paragonabili a quelle delle statine (Calder, 2006; Farooqui et al., 2007). n-3 PUFA inibisce i processi infiammatori e la sintesi di acidi grassi e colesterolo, e invece stimola l'ossidazione degli acidi grassi. Su questa base, nelle malattie infiammatorie croniche come la SM, n-3 gli acidi grassi essenziali (EFA) e n-3 PUFA dovrebbero prevalere nella dieta rispetto agli acidi grassi n-6. È interessante notare che il DHA è presente in alte concentrazioni nel cervello e che i suoi livelli diminuiscono nei pazienti con SM.
Nelle cellule microgliali in coltura attivate da LPS, l'olio di pesce è efficace quanto l'interferone-? nell'inibire l'espressione di MMP-9 (gelatinasi B), un importante mediatore della neuroinfiammazione (Liuzzi et al., 2004, 2007). Inoltre, n-3 PUFA ha ridotto significativamente i livelli di MMP-9 in pochi studi clinici, indicando che n-3 PUFA può rappresentare un buon trattamento complementare nel corso della SM (Weinstock-Guttman et al., 2005; Mehta et al., 2009 ; Shinto et al., 2009). È stato anche scoperto che l'olio di pesce migliora le prestazioni motorie in cuccioli di ratto sani (Coluccia et al., 2009).
n-3 PUFA agisce in sinergia con l'aspirina su enzimi AMPK e COX ma con meccanismi diversi. Degno di nota, in presenza di aspirina, EPA e DHA formano nuove molecole bioattive anti-infiammatorie denominate resolvins, protectine e maresine, che sono in grado di ridurre l'infiammazione cellulare e il dolore infiammatorio (Xu et al., 2010; Hong e Lu, 2013; Serhan e Chiang, 2013). Questo può essere un aspetto rilevante legato all'intervento nutrizionale nella SM. In effetti, i processi infiammatori associati alla SM potrebbero essere anche dovuti al basso rapporto omega-3 (anti-infiammatorio) / omega 6 (infiammatorio) PUFA e quindi alla bassa produzione di quantità adeguate di molecole che provocano la risoluzione lipoxins, resolvins, e protettori che sopprimono l'infiammazione. Quindi, la somministrazione di omega-3 PUFA insieme all'aspirina o direttamente di lipossine, resolvine e protidi può costituire un nuovo approccio nella prevenzione e nel trattamento della SM e di altre malattie neuroinfiammatorie. Inoltre, altri eicosanoidi antinfiammatori e antiangiogenici possono anche essere prodotti dagli enzimi P450 CYP da EPA e DHA (Yanai et al., 2014). In questo contesto, si dovrebbe tenere in considerazione che le statine possono interferire negativamente con il metabolismo di n-3 e n-6, poiché possono diminuire il rapporto n-3 / n-6. Pertanto, il trattamento con statine deve essere associato alla supplementazione di n-3 PUFA (Harris et al., 2004).
Gli oli di semi, da girasole, mais, soia e sesamo, contengono più acidi grassi n-6 rispetto agli acidi grassi n-3 e pertanto la loro assunzione dovrebbe essere limitata nella SM, al fine di limitare il livello di produzione di eicosanoidi proinfiammatori. D'altra parte, l'olio di cocco ha un alto contenuto di acidi grassi saturi. Tra gli oli vegetali, l'olio d'oliva dovrebbe essere preferito per il buon rapporto tra acidi grassi saturi e insaturi e perché contiene l'antiossidante idrossitirosolo.
Composti tiolici come integratori alimentari
I composti contenenti gruppi tiolo ( SH) come l'acido? -Lipoico (ALA), il glutatione e l'N-acetilcisteina (NAC) dovrebbero essere presi in considerazione come possibili integratori alimentari da utilizzare per il trattamento complementare della SM.
Come polifenoli, ALA (Salinthone et al., 2008; piante verdi e alimenti per animali) ha proprietà immunomodulatorie e antinfiammatorie. ALA stabilizza l'integrità del BBB e stimola la produzione di cAMP e l'attività della proteina chinasi A. Anche il NAC potrebbe essere utile nei disturbi neurologici. Passa attraverso il BBB e protegge dall'infiammazione (Bavarsad Shahripour et al., 2014).
La dieta mediterranea
Una recente revisione sistematica e una meta-analisi di studi di intervento dimostrano che i modelli di dieta mediterranea riducono l'infiammazione e il rischio di mortalità cardiovascolare e migliorano le funzioni endoteliali (Schwingshackl e Hoffmann, 2014). Questi risultati sono tanto incoraggianti quanto pensate che la vera dieta mediterranea sia leggermente diversa da quella attualmente descritta.
È generalmente riconosciuto che la dieta mediterranea si basa sul consumo di olio extravergine di oliva, cereali non raffinati, legumi, verdure diverse (in particolare pomodori) e frutta, prodotti caseari (principalmente come formaggio pecorino, ricotta, mozzarella e yogurt), pesce e prodotti della pesca e basso consumo di grassi animali e carne. Tuttavia, attualmente, la dieta mediterranea tende ad un consumo elevato di pasta e pane, il che significa un elevato apporto di glutine.
Una volta, nella vera dieta mediterranea, nel Sud Italia, la carne veniva mangiata due o al massimo tre volte alla settimana, solo l'olio d'oliva era usato per cucinare (qualità extra vergine e il più possibile crudo), ma in particolare l'assunzione di glutine era circa metà rispetto all'attuale consumo. La pasta veniva consumata con la classica salsa di pomodoro fatta in casa, ma in alternativa veniva spesso mescolata con altri alimenti senza glutine. Le ricette più comuni erano pasta e patate; pasta con fagiolini o carciofi, zucchine, melanzane, rape o cavoli; pasta con un mix di verdure e legumi (minestrone: zuppa di verdure); e pasta con ceci, fagioli o lenticchie. Le bevande zuccherate zuccherate di oggi non erano conosciute. Un'alta assunzione di alimenti ricchi di glutine può portare a una sensibilità al glutine asintomatica del glutine, a danni intestinali della mucosa, a cambiamenti nel microbiota intestinale ea infiammazioni intestinali di basso grado. In conclusione, la dieta mediterranea è buona, ma l'assunzione di glutine deve essere limitata e deve essere cereali integrali.
Stile di vita infiammatorio e antinfiammatorio
Fumo (Proinfiammatorio)
Solo pochi studi sono stati condotti sull'impatto del fumo sul corso della SM ei risultati sono contrastanti, forse perché i suoi effetti sono difficili da accertare e enucleati da altri fattori. Weiland et al. (2014) non hanno trovato alcuna associazione tra fumo e tasso di recidiva o attività della malattia, ma non escludono che i fumatori possano avere una qualità della vita significativamente più bassa della salute rispetto ai non fumatori, mentre Manouchehrinia et al. (2013) ha scoperto che il fumo è associato a una malattia più grave.
Tuttavia, come mostrato nella Figura 2, ci si può aspettare che il fumo di sigaretta possa peggiorare il decorso della SM, poiché potrebbe inibire l'attività antinfiammatoria dei Sirtuins (Caito et al., 2010). Lo stress ossidativo e carbonilico indotto dal fumo di sigaretta può essere invertito dal resveratrolo (Liu et al., 2014).
Consumo di alcol (Proinfiammatorio)
Studi recenti dimostrano che il consumo di alcol (birra, vino o liquori) non è associato al rischio di SM (Massa et al., 2013; Hedstrém et al., 2014). Tuttavia, come mostrato anche nella Figura 2, l'alcol può inibire la Sirtuin SIRT1 e attivare l'attività trascrizionale di SREBP-1c (You et al., 2008), promuovendo così la biosintesi dei lipidi e l'infiammazione a scapito del metabolismo ossidativo.
Ci sono altri due aspetti dell'etanolo che dovrebbero essere considerati. Innanzitutto, il metabolismo dell'etanolo converte un gran numero di molecole NAD + in NADH, limitando la disponibilità di NAD + richiesto per l'attività dei sirtuins. Secondo, come substrato degli enzimi P450, l'etanolo può interferire con il metabolismo dei farmaci, che vengono trasformati dagli stessi enzimi. Il risultato potrebbe essere il prolungamento e il potenziamento dell'azione della droga. Complessivamente, l'alcol deve essere considerato come una molecola che interferisce con il normale metabolismo e facilita il processo infiammatorio, complicando la possibilità di migliorare il benessere del paziente.
Restrizione calorica (antinfiammatoria)
L'apporto ipercalorico e un pasto ricco di carboidrati e zuccheri raffinati aumentano il livello di insulina e favoriscono la biosintesi, compresa la produzione di molecole proinfiammatorie e la produzione di radicali liberi. La restrizione calorica, ottenuta diminuendo l'assunzione di cibo o mediante digiuno intermittente (un giorno e l'altro no), aumenta il livello di SIRT1 (Zhang et al., 2011), aumenta il livello di AMP e aumenta l'AMPK, aumenta i livelli di adiponectina e aumenta o attivare i suoi recettori (Lee e Kwak, 2014) e ridurre il danno ossidativo, l'attivazione dei linfociti e la progressione di modelli sperimentali di SM (Piccio et al., 2008, 2013). Gli effetti della restrizione calorica possono essere imitati dagli agonisti (resveratrolo e altri polifenoli), agendo sugli stessi bersagli (SIRT1, AMPK).
Esercizio fisico (antinfiammatorio)
L'esercizio fisico è ormai una pratica quasi accettata anche per i pazienti con sclerosi multipla e viene comunemente applicato per ridurre i sintomi di affaticamento cronico e prevenire o rallentare l'insorgenza della disabilità. Tuttavia, l'importanza dell'esercizio fisico va oltre quella della semplice attività muscolare e dovrebbe essere considerata piuttosto in un contesto olistico in cui dieta, esercizio fisico, terapia e interscambio sociale giocano tutti un ruolo per il benessere dei pazienti con SM (Gacias e Casaccia, 2013).
L'OMS (2010) ha proposto un controllo dietetico e una pratica di esercizio per attenuare o prevenire le malattie croniche umane.
Da un punto di vista molecolare, l'esercizio fisico esercita il suo effetto benefico agendo sull'asse della proteina chinasi AMPK e sulle AMPK Sirtuine PPAR-? rete, sovraregolando il metabolismo ossidativo e sottoregolando le vie biosintetiche e l'infiammazione (Narkar et al., 2008). Poiché AMPK ha un ruolo chiave nel bilancio energetico, è importante menzionare i suoi agonisti. Il resveratrolo e gli agonisti dell'AMPK come la metformina, un farmaco usato nel diabete di tipo 2, possono imitare o potenziare l'effetto dell'attività fisica e sono efficaci nell'encefalite sperimentale (Nath et al., 2009).
L'esercizio fisico influenza la qualità della vita e può stimolare la produzione di citochine anti-infiammatorie (Florindo, 2014). Inoltre, l'esercizio fisico riduce i livelli plasmatici di leptina e riduce l'espressione genica dei recettori della leptina nel fegato (Yasari et al., 2009), aumentando i livelli di adiponectina e l'attività dei recettori dell'adiponectina (Lee e Kwak, 2014).
L'associazione tra esercizio fisico e restrizione calorica porta ad una riduzione significativa dei marcatori infiammatori (Reed et al., 2010).
Studi recenti condotti su topi maschi adulti C57BL / 6 J hanno dimostrato che l'esercizio stimola l'attività mitocondriale del cervello, potenzia la neuroplasticità ed è associato al miglioramento dell'umore, in quanto diminuisce i comportamenti ansiosi in campo aperto ed esercita effetti di tipo antidepressivo nella coda test di sospensione (Aguiar et al., 2014). Altri studi condotti su ratti hanno dimostrato che l'esercizio fisico può alterare la composizione e la diversità dei batteri intestinali (Petriz et al., 2014).
Per questi motivi, i pazienti affetti da sclerosi multipla dovrebbero praticare un lieve esercizio fisico (camminare a passo svelto, nuotare o persino ballare), se possibile nel corso di un programma di riabilitazione.
Sperimentazioni cliniche nutrizionali nella SM fino ad ora
Sfortunatamente, gli studi clinici nutrizionali nella SM sono solo pochissimi. Alcuni di questi erano basati su diete a basso contenuto di grassi saturi, senza integratori (Swank e Goodwin, 2003) o con integratori di grassi omega-3 (Nordvik et al., 2000; Weinstock-Guttman et al., 2005). Altre sperimentazioni cliniche si basavano esclusivamente sulla somministrazione di singoli integratori alimentari: vitamina D o olio di pesce (n-3 PUFA) o acido lipoico. Le prove cliniche con singoli polifenoli sono state eseguite solo nel cancro. Gli integratori alimentari non sono mai stati usati insieme e non sono mai stati associati alla prescrizione dietetica.
Presi insieme, i tentativi clinici di chiarire il ruolo dell'alimentazione nella SM sono stati considerati solo promettenti di scarsa qualità o senza risultati chiari (Farinotti et al., 2007, 2012). In particolare, come riportato da Farinotti et al. nella loro revisione Cochrane (2012), integratori come n-3 PUFA sembrano non avere alcun effetto importante sul principale esito clinico nella SM, ma possono ridurre la frequenza delle recidive negli anni 2. I dati disponibili sono stati considerati insufficienti o di qualità incerta per valutare un effetto reale dell'integrazione con PUFA. In alcuni studi, sono stati riscontrati lievi benefici nei risultati di recidiva con acidi grassi omega-6, ma i dati erano caratterizzati dalla ridotta validità degli endpoint. In generale, la qualità della prova è risultata scadente. Gli studi sull'integrazione vitaminica non sono stati analizzati poiché nessuno ha soddisfatto i criteri di ammissibilità, principalmente a causa della mancanza di esiti clinici. Pertanto, mancano prove sui benefici e sui rischi dell'integrazione vitaminica e degli integratori antiossidanti nella SM.
Suggerimenti per un intervento nutrizionale nella SM: la scelta della dieta e dei supplementi dietetici
Alla fine, l'obiettivo di un intervento nutrizionale nella SM deve essere il controllo dell'infiammazione e questo, come mostrato in questa recensione, può essere ottenuto principalmente controllando l'infiammazione postprandiale, la composizione del microbiota intestinale e l'infiammazione intestinale e sistemica e l'immunità. Questo può essere ottenuto con un intervento dietetico a lungo termine, con una dieta ipocalorica, prebiotici, probiotici e integratori alimentari.
Come riportato in questo articolo, molecole dietetiche sane, restrizione calorica ed esercizio fisico sono in grado di dirigere il metabolismo cellulare verso il catabolismo e ridurre l'anabolismo e l'infiammazione interagendo a diversi livelli con enzimi specifici, recettori nucleari e fattori di trascrizione. Inoltre, in associazione con la fibra, possono spostare la disbiosi intestinale in eubiosi.
Di conseguenza, pasti ipocalorici (1,600-1,800 kcal) a base di verdure, cereali integrali, legumi, frutta e pesce possono rallentare la progressione della malattia e migliorare il benessere dei pazienti con SM, mentre le diete ipercaloriche con elevato apporto di sale, grassi animali saturi, cibi fritti e bevande zuccherate possono portare all'insorgenza di infiammazioni postprandiali e infiammazioni sistemiche di basso grado.
La dieta deve essere integrata con prebiotici, probiotici, vitamine specifiche (D, A, B12 e acido nicotinico), oligoelementi (magnesio e selenio) e integratori alimentari come polifenoli, n-3 PUFA e acido lipoico.
I prebiotici per la SM dovrebbero includere inulina, crusca, lattosucrosi e oligofruttosio, nutrienti preferenziali per i colonociti e in grado di inattivare NF-kB. I probiotici, come lactococcus lactis, bifidobacterium lactis e clostridium butyricum, che possono migliorare l'equilibrio microbico intestinale, possono essere utilizzati per modificare la composizione del microbiota del colon. La combinazione di prebiotici e probiotici è altamente raccomandata. Le funzioni intestinali e il peso dovrebbero essere sempre sotto controllo.
Un approccio terapeutico più drastico volto a ripristinare l'eubiosi intestinale e la sottoregolazione dell'infiammazione può essere rappresentato dal trapianto di microbiota fecale (FMT; Smits et al., 2013). Il metodo sembra essere molto efficace ma ancora primitivo, non del tutto sicuro e in un certo senso anche disgustoso. Il campo dovrebbe andare oltre i trapianti fecali, identificare gli organismi che possono essere essenziali per una particolare condizione e fornire quegli organismi in un modo molto più semplice di FMT (Critical Views in Gastroenterology & Hepatology, 2014).
Gli integratori alimentari, con la sola eccezione degli omega-3 PUFA, che sono normali costituenti del nostro organismo, sono utili all'inizio dell'intervento nutrizionale, o in corso di ricadute, per facilitare il recupero di una condizione di salute, ma il loro utilizzo dovrebbe essere limitato a un periodo di tempo limitato (3 4 mesi). Ciò è particolarmente valido per i polifenoli. I polifenoli non sono molecole ben note per quanto riguarda la loro biodisponibilità e i loro effetti biologici e dovrebbero essere utilizzate precauzioni speciali quando si integra la dieta con essi. Da un lato, possono sottoregolare la sintesi di molecole proinfiammatorie nel corso dei processi infiammatori; d'altra parte, possono stimolare l'attività cellulare nelle cellule a riposo, ma una stimolazione persistente può indurre l'apoptosi delle cellule sane. Prese insieme, queste considerazioni suggeriscono che la somministrazione di polifenoli purificati dovrebbe essere eseguita sulla base di studi clinici preliminari per testare la loro efficacia come integratori alimentari e per determinare la loro sicurezza a lungo termine e il giusto dosaggio.
In generale, un intervento nutrizionale con alimenti antinfiammatori e integratori alimentari diminuisce la biosintesi dei composti proinfiammatori e rende quindi più efficace l'uso di farmaci immunomodulatori, e alla fine potrebbe limitare i loro possibili effetti avversi, alleviare i sintomi della sindrome da stanchezza cronica, e favorire il benessere del paziente. Tuttavia, dieta e integratori alimentari non dovrebbero essere trattati come farmaci e come sostituti della terapia. Allo stesso modo, il cibo proinfiammatorio non è tossico e non è necessario escluderlo del tutto. Puoi mangiare una bella bistecca o cibo fritto senza rischi o sensi di colpa, se sei in condizioni sostanzialmente salutari. Ciò che fa male sono le abitudini alimentari sbagliate a lungo termine.

La sclerosi multipla, o SM, è una malattia cronica progressiva che comporta danni alle guaine mieliniche delle cellule nervose. L'epidemiologia della SM suggerisce che vari fattori sono spesso coinvolti nell'espressione clinica del problema di salute. Tuttavia, numerosi studi di ricerca hanno principalmente valutato il ruolo della dieta sullo sviluppo della sclerosi multipla. Per diversi anni, gli operatori sanitari hanno ritenuto che esistesse una correlazione tra il consumo di prodotti lattiero-caseari nei pazienti con sclerosi multipla. Secondo diversi studi di ricerca, è stata trovata una correlazione significativa tra latte vaccino e la prevalenza della sclerosi multipla, suggerendo un possibile ruolo dei prodotti lattiero-caseari nell'eziologia multifattoriale della SM. Dr. Alex Jimenez DC, CCST
Conclusioni
Quindi, a prima vista, la SM non sembra avere alcuna delle caratteristiche delle malattie infiammatorie croniche, che potrebbero essere correlate a abitudini alimentari e stili di vita sbagliati, o anche a un microbiota intestinale disbiotico. Apparentemente non c'è nulla in una esacerbazione della malattia che possa essere collegata al cibo o allo stato del microbiota intestinale. Infatti, quando iniziammo i nostri studi sull'impatto della nutrizione sulla SM, non c'era nemmeno la più pallida idea che potesse esistere un vero legame tra loro, e l'idea del coinvolgimento del microbiota intestinale nella SM era considerata solo molto speculativa. Ad oggi, l'idea che le abitudini alimentari possano influenzare il corso della SM sta ancora cercando di imporsi. Non così nelle malattie cardiovascolari e in altre condizioni infiammatorie croniche, in cui l'influenza delle abitudini alimentari è quasi accettata, e nemmeno nel cancro, che è sempre più considerato come una malattia metabolica (Seyfried et al., 2014).
Allo stato attuale, la terapia con SM non è associata ad alcuna dieta particolare, probabilmente a causa della mancanza di informazioni sugli effetti della nutrizione sulla malattia. Tuttavia, la maggior parte dei pazienti con SM sta cercando trattamenti complementari e alternativi (CAM), e in particolare sta cercando di cambiare le abitudini alimentari, quasi senza il parere del medico (Schwarz et al., 2008; Leong et al., 2009 ). Un recente studio basato sui dati forniti dai pazienti con SM in risposta a un questionario sulle loro abitudini alimentari sembra supportare un'associazione significativa di abitudini alimentari sane con una migliore qualità della vita fisica e mentale correlata alla salute e un livello inferiore di disabilità (Hadgkiss et al. ., 2014). Questi dati rafforzano l'idea della necessità di studi randomizzati e controllati sull'intervento nutrizionale per le persone con SM. Va sottolineato che i trattamenti nutrizionali dovrebbero essere complementari, ma non alternativi alla terapia, essere parte di un approccio olistico ed essere eseguiti sotto controllo medico.
Poiché non ci sono ancora dati disponibili dagli studi clinici, il nostro lavoro è finalizzato a razionalizzare le scelte dietetiche sulla base degli effetti noti e stabiliti dei fattori dietetici e dello stile di vita a livello molecolare. I dati riportati nella figura 2 non sono ovviamente completi, ma possono essere utili per fornire linee guida per gli interventi nutrizionali. In linea di principio, il cibo proinfiammatorio sovraregolamenta le vie biosintetiche e infiammatorie, come mostrato a destra e nella parte inferiore della Figura 2, mentre il cibo anti-infiammatorio aumenta il metabolismo ossidativo e diminuisce l'anabolismo e l'infiammazione.
Come mostrato in questo articolo, la scoperta che la restrizione calorica, l'esercizio fisico e particolari fattori dietetici possono influenzare il grado di risposta infiammatoria agendo sia sul metabolismo cellulare (Figura 2) che sulla composizione del microbiota intestinale (Figura 5), suggerisce che un adeguato nutrizionale l'intervento può migliorare il decorso della malattia e può quindi essere preso in considerazione come possibile trattamento complementare nella SM. Poiché l'infiammazione è presente sia in RRMS che in PPMS, i consigli nutrizionali sono indicati per entrambe le forme della malattia. Ciò è particolarmente importante nel caso di PPMS, per il quale non è attualmente disponibile alcuna cura. Viceversa, poiché le abitudini alimentari specifiche possono essere dannose e possono favorire uno stato cronico di infiammazione di basso grado, una dieta sbagliata può essere considerata una possibile causa di recidiva nella SM.
Nel complesso, ora abbiamo una migliore conoscenza della possibile influenza dei fattori dietetici sul metabolismo cellulare e sul microbiota intestinale, e sui loro possibili effetti sulla malattia, ma, chiaramente, stiamo solo iniziando a capire il ruolo della nutrizione e del microbiota intestinale nella SM e resta ancora molto lavoro in termini di comprensione della natura delle interazioni del microbiota intestinale con il sistema immunitario dell'ospite, specialmente nei siti distali all'intestino.
Per questi motivi, le prospettive future nella ricerca sulla SM dovrebbero considerare i seguenti punti: (a) valutare la composizione del microbiota intestinale; (b) valutare i difetti del sistema immunitario intestinale; (c) chiarire il ruolo dei polifenoli e del metabolismo della vitamina D; (d) studiare l'impatto di fattori dietetici, erbe e farmaci su AMPK, Sirtuins, PPAR o direttamente su NF-kB. Degni di nota, alcuni farmaci usati per curare il diabete di tipo II, come il PPAR-? gli agonisti tiazolidinedioni (Bernardo et al., 2009) e l'agonista AMPK metformina (Nath et al., 2009) hanno effetti antinfiammatori paragonabili a quelli dei fattori dietetici antinfiammatori; (e) definire le possibili interferenze tra integratori alimentari e farmaci per la SM; (f) promuovere una campagna volta a educare sull'importanza di seguire una dieta sana durante la terapia, ad esempio incoraggiando i pazienti a includere fibre o carboidrati complessi nella loro dieta, integrando con probiotici, scegliendo grassi n-3 rispetto a grassi n-6 proinfiammatori e limitare il consumo di carne e grassi animali. La scelta di buone ricette, come quelle descritte da Mollie Katzen (2013), può rendere la dieta più accettabile.
Complessivamente, le terapie convenzionali SM immunomodulatorie hanno avuto quasi successo; tuttavia, mancano ancora farmaci che possano proteggere e favorire i meccanismi di riparazione. Possiamo decidere di aiutare le persone a mantenersi in salute fornendo indicazioni nutrizionali e opportunità di attività fisica. Per il momento, ci sono solo buone prospettive per migliorare il benessere dei pazienti con SM. Siamo solo all'inizio della storia.
Sommario
Poiché sia la SM recidivante-remittente che la SM primaria-progressiva sono malattie infiammatorie, possono essere influenzate da abitudini e stile di vita proinfiammatori o antinfiammatori attraverso la loro azione sul metabolismo cellulare e sul microbiota intestinale. I consigli nutrizionali per i pazienti con SM possono favorire il loro benessere.
Dichiarazione di interessi in conflitto
Gli autori non hanno dichiarato potenziali conflitti di interesse rispetto alla ricerca, paternità e / o pubblicazione di questo articolo.
Finanziamento
Gli autori hanno reso noto di aver ricevuto il seguente sostegno finanziario per la ricerca, la paternità e / o la pubblicazione di questo articolo: Questo lavoro è sostenuto dalla Fondazione Italiana per la Sclerosi Multipla (FISM) con sovvenzioni 2007 / R / 15 per il Progetto Salute e Functional Foods for MS pazienti, 2010 / R / 35 per il progetto The Molecular Basis for Nutritional Intervention in Multiple Sclerosis, e 2014 / S / 2 (2014 2015) per il progetto Nutritional Facts in Multiple Sclerosis: Why They Sono importanti e come dovrebbero essere gestiti per le pubbliche relazioni
Molti medici raccomandano vivamente che i pazienti con sclerosi multipla, o SM, evitino i latticini perché vari studi di ricerca hanno dimostrato un'elevata correlazione tra SM e latticini, in particolare il latte vaccino. Ciò è in gran parte dovuto al fatto che le proteine nel latte vaccino sono generalmente prese di mira dal sistema immunitario dei pazienti con sclerosi multipla. Inoltre, alcune proteine nel latte vaccino imitano parte della mielina oligodendrocita glicoproteina, o MOG, la sezione della mielina che innesca la risposta autoimmune nella sclerosi multipla che può ingannare il sistema immunitario per attaccare e distruggere il MOG. Informazioni referenziate dal National Center for Biotechnology Information (NCBI). Lo scopo delle nostre informazioni è limitato ai problemi di salute della colonna vertebrale e della chiropratica. Per discutere l'argomento, non esitate a chiedere al Dr. Jimenez o contattarci a 915-850-0900 .
A cura di Dr. Alex Jimenez
Riferito da: Ncbi.nlm.nih.gov/pmc/articles/PMC4342365/

Discussione aggiuntiva sull'argomento: Dolore alla schiena acuto
Mal di schienaè una delle cause più diffuse di disabilità e di giornate di lavoro perse in tutto il mondo. Il dolore alla schiena si attribuisce al secondo motivo più comune per le visite presso l'ambulatorio medico, superato solo dalle infezioni delle vie respiratorie superiori. Circa l'80% della popolazione sperimenterà dolore alla schiena almeno una volta nella vita. La colonna vertebrale è una struttura complessa composta da ossa, articolazioni, legamenti e muscoli, tra gli altri tessuti molli. Lesioni e / o condizioni aggravate, come dischi erniciati, può eventualmente portare a sintomi di mal di schiena. Gli infortuni sportivi o gli incidenti automobilistici sono spesso la causa più frequente di mal di schiena, tuttavia, a volte il più semplice dei movimenti può avere risultati dolorosi. Fortunatamente, opzioni di trattamento alternative, come la cura chiropratica, possono aiutare ad alleviare il mal di schiena attraverso l'uso di aggiustamenti spinali e manipolazioni manuali, migliorando in definitiva il sollievo dal dolore.

EXTRA EXTRA | ARGOMENTO IMPORTANTE: consigliato El Paso, TX Chiropractor
***
Le informazioni qui riportate su "Fatti di nutrizione nella sclerosi multipla" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale






