Tagliare il tuo nervo cambia il tuo cervello | El Paso, TX.
Dopo la transezione del nervo periferico dell'arto superiore e la riparazione chirurgica, alcuni pazienti riacquistano una buona funzione sensomotoria mentre altri no. La comprensione dei meccanismi periferici e centrali che contribuiscono al recupero può facilitare lo sviluppo di nuovi interventi terapeutici. La plasticità dopo la transezione del nervo periferico è stata dimostrata in tutta la neuroasse in modelli animali di lesione nervosa. Tuttavia, i cambiamenti cerebrali che si verificano dopo la transezione del nervo periferico e la riparazione chirurgica negli esseri umani non sono stati esaminati. Inoltre, la misura in cui la rigenerazione dei nervi periferici influenza i cambiamenti cerebrali funzionali e strutturali non è stata caratterizzata. Pertanto, ci siamo chiesti se i cambiamenti funzionali sono accompagnati da cambiamenti strutturali della materia grigia e / o bianca e se questi cambiamenti sono correlati al recupero sensoriale? Per affrontare questi problemi chiave abbiamo (i) valutato la rigenerazione dei nervi periferici; (ii) attivazione cerebrale di risonanza magnetica funzionale misurata (segnale dipendente dal livello di ossigeno nel sangue; BOLD) in risposta a uno stimolo vibrotattile; (iii) ha esaminato la plasticità strutturale cerebrale della materia grigia e bianca; e (iv) misure di recupero sensoriale correlate con i cambiamenti della materia grigia nella transezione del nervo periferico e nei pazienti con riparazione chirurgica. Rispetto al nervo contralesionale sano di ogni paziente, i nervi sezionati hanno una conduzione nervosa compromessa 1.5 anni dopo la transezione e la riparazione, conducendo con ampiezza ridotta e latenza aumentata. Rispetto ai controlli sani, la transezione del nervo periferico e la riparazione chirurgica i pazienti avevano alterato l'attività del segnale dipendente dal livello di ossigeno nel sangue nelle cortecce somatosensoriali primarie e secondarie contralesionali e in un insieme di aree cerebrali note come `` rete positiva dell'attività ''. Inoltre, sono state identificate riduzioni della materia grigia in diverse aree del cervello, comprese le cortecce somatosensoriali primarie e secondarie controlesionali, nelle stesse aree in cui sono state identificate riduzioni del segnale dipendenti dal livello di ossigeno nel sangue. Inoltre, l'assottigliamento della materia grigia nel giro post-centrale è stato correlato negativamente con misure di recupero sensoriale (rilevamento meccanico e vibratorio) dimostrando un chiaro legame tra funzione e struttura. Infine, abbiamo identificato una ridotta anisotropia frazionaria della sostanza bianca nell'insula destra in una regione che ha anche dimostrato una riduzione della materia grigia. Questi risultati forniscono informazioni sulla plasticità cerebrale e sulle relazioni struttura-funzione-comportamentale in seguito a lesioni nervose e hanno importanti implicazioni terapeutiche.
Parole chiave: spessore corticale; fMRI; imaging del tensore di diffusione; plasticità; lesione del nervo periferico
Abbreviazioni: BA = area di Brodmann; BOLD = dipendente dal livello di ossigeno nel sangue; fMRI = risonanza magnetica funzionale;
PNIr = transezione del nervo periferico e riparazione chirurgica; S1 = corteccia somatosensoriale primaria; S2 = corteccia somatosensoriale secondaria
Introduzione
Dopo la transezione del nervo periferico dell'arto superiore e la riparazione chirurgica (PNIr), il 25% dei pazienti non è tornato al lavoro 1.5 anni dopo l'intervento (Jaquet et al., 2001). Inoltre, il 57% dei pazienti con lesioni nervose ha un'età compresa tra 16 e 35 anni (McAllister et al., 1996); quindi, una lunga vita di disabilità e difficoltà economiche possono accompagnare la transezione del nervo degli arti superiori. Comprendere le ramificazioni centrali e periferiche della lesione del nervo periferico può facilitare lo sviluppo di nuove strategie terapeutiche e programmi di intervento.
Non è noto come il cervello risponde al PNIr negli esseri umani. Tuttavia, studi su animali hanno stabilito che la plasticità all'interno della corteccia somatosensoriale inizia immediatamente dopo la transezione dei nervi periferici, e che 1 anno dopo completa transezione nervosa e riparazione chirurgica, le mappe corticali contengono rappresentazioni frammentarie e non continue dei nervi transetti e adiacenti (Wall et al. ., 1986). Si pensa che i meccanismi che facilitano la plasticità funzionale includano lo smascheramento immediato di proiezioni preesistenti dai livelli corticali e subcorticali adiacenti e il germogliamento a lungo termine degli assoni a livelli multipli del neuroaxis, compresa la corteccia somatosensoriale primaria (S1) (Firenze e Kaas , 1995; Hickmott and Steen, 2005).
Studi di imaging cerebrale umano hanno confermato i risultati di modelli animali con l'identificazione di alterazioni delle mappe di attivazione funzionale della RM a causa di lesioni del midollo spinale, amputazione, trasferimento del to-to-pollice e in pazienti con sindrome del tunnel carpale (Lotze et al., 2001; Manduch et al., 2002; Jurkiewicz et al., 2006; Napadow et al., 2006). Inoltre, studi di risonanza magnetica strutturale hanno recentemente visualizzato variazioni di materia grigia e bianca in seguito a lesioni traumatiche e in diverse condizioni patologiche, tra cui l'amputazione dell'arto e il dolore cronico (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008; Geha et al., 2008; May, 2008). Si ritiene che i cambiamenti della materia grigia siano correlati ai cambiamenti delle dimensioni delle cellule, atrofia e / o perdita di neuroni o glia, mentre i cambiamenti della sostanza bianca sono influenzati dalla degenerazione assonale e dalla perdita di mielina (Beaulieu, 2002; May, 2008).
Un potente approccio per delineare i meccanismi della patologia e della plasticità consiste nel combinare tecniche di imaging di materia grigia e bianca per la tecnica funzionale e strutturale. Abbiamo precedentemente riportato che i pazienti con PNIr completo dell'arto superiore hanno mantenuto profondi deficit somatosensoriali che persistono negli anni 41.5 dopo l'intervento chirurgico (Taylor et al., 2008a). Sulla base di questi risultati, abbiamo ipotizzato che questi pazienti mostrassero cambiamenti cerebrali funzionali e strutturali in aree cerebrali somatosensoriali chiave. Pertanto, in questo studio, abbiamo ipotizzato che i pazienti con PNIr avrebbero: (i) riduzione delle risposte di livello di ossigeno nel sangue (BOLD) alla stimolazione vibratoria del territorio del nervo transeunte, nella regione di S1 che rappresenta l'arto superiore danneggiato e nel secondario corteccia somatosensoriale (S2); (ii) una corrispondente riduzione dello spessore corticale in queste regioni del contralesional S1 e S2; (iii) una correlazione tra i cambiamenti nello spessore corticale e le misure psicofisiche della funzione somatosensoriale (vibrazioni e soglia di rilevamento del tatto); e (iv) riduzione dell'anisotropia frazionale (una misura dell'integrità della sostanza bianca) nella materia bianca che si nutre dentro / fuori da queste aree corticali somatosensoriali.
Metodi
Soggetti
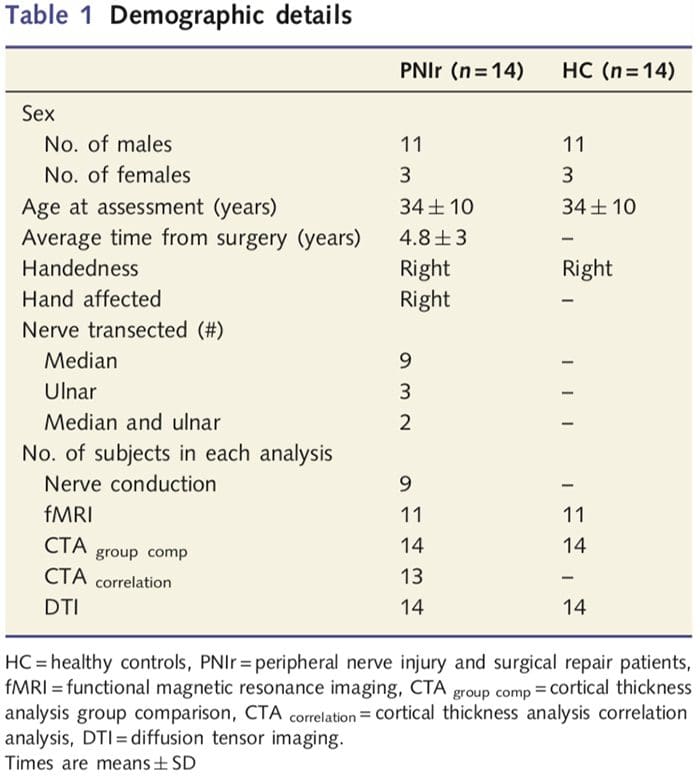
Abbiamo reclutato 27 pazienti con transezione completa del nervo mediano e / o ulnare seguita da riparazione chirurgica da chirurghi plastici affiliati al programma mani dell'Università di Toronto tra giugno 2006 e maggio 2008. Di questa coorte più ampia, 14 pazienti senza dolore (tre femmine , 11 maschi; 34 ± 10 anni) con transezione completa del nervo mediano destro e / o ulnare sono stati inclusi nello studio [per evitare confusioni legate alla presenza di dolore e lateralità pazienti con dolore (n = 6) e lesioni del lato sinistro (n = 7) sono stati esclusi da questa analisi]. Tutti i pazienti sono stati sottoposti a riparazione del nervo microchirurgico almeno 1.5 anni prima dell'arruolamento nello studio (il tempo di recupero variava da 1.5 a 8 anni). Inoltre, abbiamo reclutato 14 controlli sani abbinati per età e sesso (3 femmine, 11 maschi; 34-10 anni). Tutti i soggetti hanno dato il consenso scritto informato alle procedure approvate dal Comitato Etico della Ricerca della Rete Sanitaria dell'Università. Tutti i soggetti erano destrimani (determinati utilizzando l'inventario della manualità di Edimburgo: Oldfield, 1971) e non avevano precedenti di lesioni neurologiche o dolore cronico (né prima né dopo la transezione nervosa). Vedere la tabella 1 per i dettagli demografici.
disegno dello studio
Tutti i soggetti hanno partecipato a una sessione di imaging che comprendeva: (i) risonanza magnetica funzionale (fMRI) in risposta a stimoli vibrotattili applicati al dito indice destro (nel territorio del nervo mediano); (ii) una scansione anatomica ad alta risoluzione dell'intero cervello, acquisita per la registrazione delle immagini e per l'analisi della materia grigia corticale; e (iii) due scansioni di imaging del tensore di diffusione per la valutazione dell'integrità della sostanza bianca. Prima dell'imaging, i soggetti sono stati istruiti nel progetto di base dell'esperimento e hanno ricordato di rimanere il più fermi possibile durante tutta la durata della scansione.
I soggetti erano liberi di ritirarsi dallo studio in qualsiasi momento. Inoltre, è stata eseguita una valutazione sensoriale e motoria per tutti i soggetti (Taylor et al., 2008a). Poiché le soglie di rilevamento del contatto e della vibrazione erano correlate con lo spessore corticale, una descrizione di questi metodi è inclusa di seguito (altre misure psicofisiche saranno riportate altrove).
Soglia di vibrazione
Le soglie di rilevamento delle vibrazioni sono state determinate utilizzando un Bio-Thesiometer manuale (Bio-Medical Instrument Company, USA). Il dispositivo ha una sonda 12-mm che è stata posizionata sulla falange distale dell'indice destro (D2). Le soglie sono state determinate utilizzando il metodo dei limiti: l'ampiezza (tensione) è stata gradualmente aumentata fino a quando il soggetto ha indicato di aver percepito lo stimolo. Le soglie di vibrazione sono state acquisite tre volte e un valore medio è stato calcolato. Durante il test della soglia di vibrazione, i soggetti sono stati istruiti a chiudere gli occhi e appoggiare il dorso della mano su un cuscino di supporto.
Soglia di rilevamento meccanico
Le soglie di rilevamento meccanico sono state determinate utilizzando un set standardizzato di filamenti di von Frey (OptiHair2 Marstock Nervtest, Germania) contenente 12 filamenti calibrati distanziati logaritmicamente che hanno erogato forze da 0.25-512 mN. Il diametro della superficie di contatto di tutti i 12 filamenti era di circa 0.4 mm. Le prove sono state condotte con gli occhi del soggetto chiusi e le mani appoggiate su un morbido cuscino. Le sonde sono state applicate in una serie ascendente e ai soggetti è stato richiesto di rispondere ogni volta che sentivano una sonda toccare la punta del dito D2 destro. Questo processo è stato ripetuto tre volte. La forza per il filamento che è stata rilevata in almeno due delle tre prove è stata riportata come soglia di rilevamento meccanico di quel soggetto.
Test di conduzione nervosa
I pazienti hanno partecipato a studi bilaterali sulla conduzione dei nervi sensoriali e motori presso la clinica di elettromiografia (EMG) del Toronto Western Hospital. Per la conduzione del nervo motore, l'elettrodo stimolante è stato posizionato al polso e al gomito (separatamente) e l'elettrodo di registrazione è stato posizionato sull'abduttore pollicis brevis, per la valutazione del nervo mediano, o sull'abduttore digiti minimi per la valutazione del nervo ulnare. Per il test del nervo sensoriale l'elettrodo di registrazione è stato posizionato al polso e l'elettrodo stimolante è stato posizionato alle cifre D2, D3 e D5. Un neurologo senior ed esperto della clinica EMG del Toronto Western Hospital (Dr Peter Ashby) ha riesaminato tutte le valutazioni cliniche per determinare quali nervi mostravano risposte normali / anormali. Poiché è noto che le misure di ampiezza e latenza variano sostanzialmente tra i soggetti (a causa di fattori quali la densità di innervazione, la profondità del nervo e lo spessore della pelle di un singolo soggetto) (Kimura, 2001) il nervo non trattato di ogni paziente serviva come controllo per il confronto con i valori dal lato sezionato. In quei pazienti con risposte di conduzione nervosa rilevabili, sono stati eseguiti test t accoppiati per valutare la differenza nelle misure di latenza o ampiezza tra i nervi sezionati e contralesionali di ciascun paziente non transecati.
Parametri di imaging
I dati di imaging cerebrale sono stati acquisiti utilizzando un sistema 3T GE MRI dotato di una bobina di testa phased array a otto canali. I soggetti sono stati posizionati supini sul tavolo per risonanza magnetica e la testa di ogni soggetto è stata imbottita per ridurre il movimento. I dati fMRI dell'intero cervello sono stati acquisiti utilizzando l'imaging eco planare (28 sezioni assiali, campo visivo (FOV) = 20 x 20 cm, matrice 64 x 64, voxel 3.125 x 3.125 x 4 mm, tempo di eco (TE) = 30 ms, ripetizione tempo (TR) = 2000 ms). Il tempo di scansione è stato di 5 min e 8 s (154 frame). Durante la scansione, è stato applicato uno stimolo vibrotattile non doloroso a 12 Hz alla falange distale del D2 destro utilizzando diaframmi a palloncino azionati da aria compressa (dispositivo prodotto dal dott. Christo Pantev; www.biomag.uni-muenster.de). Gli stimoli sono stati erogati in blocchi di 10 intercalati con 20 di riposo, per un totale di 10 blocchi di stimolazione e 10 blocchi di riposo. I primi 8 s (4 TR) di dati acquisiti da ciascuna corsa sono stati scartati per consentire l'equilibrio del segnale fMRI. Ai soggetti è stato chiesto di tenere gli occhi chiusi durante la scansione e di concentrarsi sugli stimoli. Una scansione anatomica tridimensionale (3D) dell'intero cervello ad alta risoluzione (124 fette sagittali, FOV 24 x 24 cm, matrice 256 x 256, 1.5 x 0.94 x 0.94 mm voxel) è stata acquisita con una sequenza di eco gradiente alterato 1D pesato in T3 (un segnale medio, angolo di ribaltamento = 20? , TE ?5 ms). Inoltre, sono state acquisite due scansioni di imaging del tensore di diffusione (38 sezioni assiali, FOV 24 x 24 cm, matrice 128 x 128, voxel 1.875 x 1.875 x 3 mm) lungo 23 direzioni con un valore b di 1000 mm²2. Ogni corsa conteneva anche due volumi senza ponderazione della diffusione.
Analisi fMRI
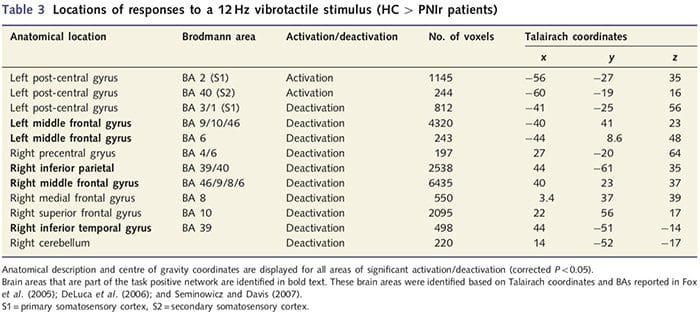
I dati sono stati analizzati utilizzando Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Paesi Bassi). Pre-elaborazione inclusa: correzione del movimento 3D, correzione del tempo di scansione delle sezioni, rimozione lineare delle tendenze, filtraggio passa-alto (cinque cicli per corsa) e livellamento spaziale con un kernel gaussiano 6mm a larghezza intera a metà massimo (FWHM). I set di dati fMRI sono stati interpolati ai voxel 3 x 3 x 3 mm, registrati sull'immagine ad alta risoluzione e normalizzati allo spazio Talairach standard (Talairach e Tournoux, 1988). I voxel sono indicati come 1 x 1 x 1 mm. I dati sono stati analizzati utilizzando il modello lineare generale; il modello è stato ottenuto convolvendo la funzione boxcar del decorso temporale della stimolazione tattile con la funzione di risposta emodinamica standard. Per identificare tra le differenze di gruppo nei modelli di attivazione è stata eseguita un'analisi degli effetti fissi con i contrasti: (i) controlli sani: stimolazione 4 riposo; (ii) PNIr: stimolazione del riposo 4; e (iii) controlli sani 4 PNIr. Le mappe di attivazione sono state impostate a un valore corretto di P50.05 (derivato da voxel contigui P50.0001 e 120mm3 non corretti come precedentemente riportato: Taylor e Davis, 2009); questo è stato anche validato eseguendo una simulazione Monte Carlo con l'applicazione AlphaSim implementata nel software AFNI (Analysis of Functional Neuroimage). Questa analisi includeva solo i pazienti 11 che sostenevano la transezione del nervo mediano destro (n = 9) o della mediana destra e del nervo ulnare (n = 2) (cioè i tre pazienti con una transezione del nervo ulnare destro puro non erano inclusi in questa analisi ).
Analisi dello spessore corticale
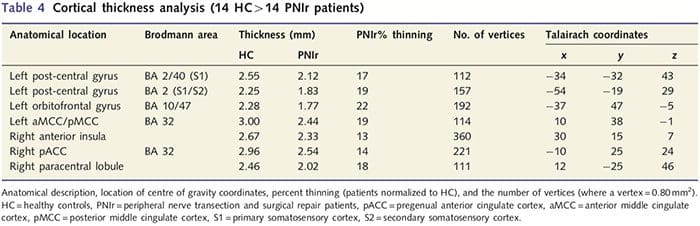
L'analisi dello spessore corticale è stata eseguita utilizzando Freesurfer (http: // surfer.nmr.mgh.harvard.edu); metodi sono stati descritti in dettaglio altrove (Dale et al., 1999; Fischl et al., 1999a, b; Fischl e Dale 2000). In breve, i set di dati anatomici pesati in T1 ad alta risoluzione sono stati registrati nell'atlante di Talairach (Talairach e Tournoux, 1988). Questo è stato seguito dalla normalizzazione dell'intensità, dalla rimozione del cranio e dalla separazione degli emisferi. Successivamente, sono stati identificati e segmentati i confini della materia bianca / grigia (chiamata superficie bianca) e grigia / CSF (chiamata superficie piale). La distanza tra la superficie bianca e quella piale è stata quindi calcolata in ogni punto di ciascun emisfero del cervello. Per identificare le differenze di gruppo tra i 14 pazienti e i 14 controlli abbinati per età / sesso, è stata eseguita un'analisi del modello lineare generale in ogni punto del cervello. Poiché la topografia corticale dell'individuo è intrinsecamente eterogenea, è stato applicato un kernel di levigatura spaziale FWHM da 5 mm prima dell'analisi statistica. I dati vengono visualizzati con un P50.05 corretto (derivato da un P50.0075 non corretto e 102 vertici contigui); questo è stato calcolato eseguendo una simulazione Monte Carlo con AlphaSim. Un vertice rappresenta un punto su un foglio bidimensionale e, in questo studio, la distanza tra due vertici è 0.80mm2.
Poiché i pazienti mostravano deficit significativi nella funzione somatosensoriale all'interno del territorio del nervo transecato, abbiamo ipotizzato che le misure della funzione somatosensoriale (vibrazione e rilevamento del tocco) sarebbero correlate con lo spessore corticale nel giro post-centrale contralesionale (corteccia somatosensoriale primaria e secondaria). Pertanto, abbiamo eseguito analisi di correlazione nel gruppo di pazienti tra: (i) spessore corticale e soglia di rilevamento delle vibrazioni; e (ii) spessore corticale e soglie di rilevamento del tocco. Un paziente non ha completato la valutazione psicofisica; pertanto, questa analisi ha incluso 13 pazienti PNIr. Inoltre, per determinare se c'era una relazione tra spessore corticale e tempo di recupero, è stata eseguita anche un'analisi di correlazione tra queste due misure. Queste analisi di correlazione sono state limitate al giro post-centrale contralesionale includendo una maschera (presa da Freesurfer's built in atlas) nel modello lineare generale. È stata eseguita una simulazione Monte Carlo limitata al numero di vertici all'interno del giro post-centrale contralesionale; le immagini vengono visualizzate con un P50.05 corretto (derivato da un P50.0075 non corretto e 68 vertici contigui).
Analisi dell'imaging del tensore di diffusione
L'elaborazione dell'immagine del tensore di diffusione è stata eseguita con DTiStudio (www.MriStudio.org) e FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Le immagini sono state inizialmente riallineate con lo strumento di registrazione automatica delle immagini implementato in DTiStudio, utilizzando la prima immagine B0 della prima serie acquisita come modello. Questo processo corregge il movimento del soggetto e la distorsione da correnti parassite. Tutte le immagini sono state quindi ispezionate visivamente per valutare la qualità dell'immagine e l'allineamento dei percorsi di imaging del tensore di diffusione separati. Se è stato rilevato un artefatto, la fetta è stata rimossa prima di calcolare la media delle due analisi di imaging del tensore di diffusione separate. Le mappe FA individuali sono state calcolate utilizzando lo strumento DTIFIT implementato in FSL. L'analisi statistica voxel-wise è stata eseguita per identificare le differenze di gruppo nell'anisotropia frazionaria media utilizzando le statistiche spaziali basate sul tratto; per una descrizione completa di questi metodi vedere Smith et al. (2006). In breve, le immagini sono state registrate in modo non lineare su un'immagine target (MNI152), l'immagine media è stata quindi creata da tutti i set di dati e questa immagine è stata successivamente assottigliata per rappresentare tutti i tratti comuni a tutti i soggetti. I valori di anisotropia frazionaria più elevati di ciascun soggetto sono stati quindi proiettati sullo scheletro cercando nella materia bianca perpendicolare a ciascun punto dello scheletro della materia bianca. È stata quindi eseguita un'analisi statistica voxel dell'intero cervello tra i gruppi (14PNIr e 14 controlli sani) e le immagini sono state corrette l'intero cervello a P50.05. Inoltre, è stata eseguita un'analisi della regione di interesse nella sostanza bianca tratti adiacente al S1 controlaterale, al talamo e all'insula bilaterale anteriore e posteriore. Queste regioni sono state scelte in quanto precedentemente coinvolte in aspetti di somatosensazione e perché corrispondono a regioni identificate nelle analisi del gruppo fMRI e analisi dello spessore corticale (CTA). Le regioni di interesse sono state disegnate sullo scheletro della materia bianca come segue: (i) La regione di interesse controlaterale S1 è originata medialmente alla giunzione tra lo scheletro della materia bianca della corona radiata e la sezione dello scheletro che si alimenta nel giro post-centrale; terminando alla fine del tratto all'interno di una data fetta.
Nella direzione z la regione di interesse si estendeva da z = 49 a 57; tratti di sostanza bianca che riforniscono la regione della mano. (ii) La regione di interesse del talamo controlaterale era limitata alle tracce di sostanza bianca che circondavano i nuclei talamici posteriori e mediali (nuclei coinvolti nella funzione somatosensoriale), che si estendevano da z = 1 a 4. (iii) Le regioni di interesse insulari erano disegnate bilateralmente all'interno materia bianca adiacente all'isola anteriore e posteriore sulla base di criteri precedentemente pubblicati dal nostro laboratorio (Taylor et al., 2008b). La regione di interesse si estendeva da z = 2 a 8. I valori di anisotropia frazionaria sono stati estratti da ciascuna di queste regioni di interesse ed è stata eseguita un'analisi multivariata della varianza (MANOVA) utilizzando il pacchetto statistico per le scienze sociali v13.0 (SPSS Inc, Chicago), che includeva valori di anisotropia frazionaria per tutte e sei le regioni di interesse.
Risultati
La tabella 1 fornisce dettagli demografici per i partecipanti allo studio. Tutti i 14 pazienti hanno subito una transezione completa del nervo mediano destro e / o ulnare seguita da riparazione microchirurgica almeno 1.5 anni prima dell'arruolamento nello studio. Il tempo dall'intervento al test variava da 1.5 a 8 anni con una media (? SD) di 4.8? 3 anni. Pazienti e controlli no (34-10 anni entrambi i gruppi; t = 0.04; P = 0.97).
psicofisica
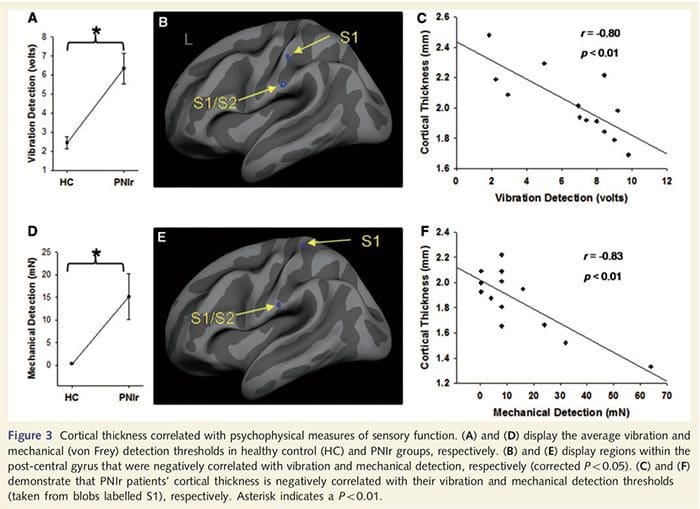
Le soglie di vibrazione sono state calcolate da tutte e tre le misurazioni poiché l'analisi della varianza a ripetizione a una via (ANOVA) non ha indicato differenze significative tra le tre prove [F (25, 1) = 0.227, P = 0.64]. I treppiedi di vibrazione e di rilevamento meccanico erano significativamente compromessi nei pazienti con PNIr rispetto ai controlli sani (vibrazione: t = 4.77, P50.001, Fig. 3A; meccanico: t = 3.10, P = 0.005, Fig. 3D).
Test di conduzione nervosa
Le misure di ampiezza e latenza ottenute dai nervi contralesionali di ciascun paziente sono state classificate come normali da un neurologo esperto presso la clinica EMG del Toronto Western Hospital. Nove dei 14 pazienti hanno completato il test di conduzione nervosa. La tabella 2 mostra i dati medi di aumento / diminuzione della latenza e dell'ampiezza per la conduzione del nervo sensoriale dal polso ai muscoli abduttori pollicis brevis (mediana) o abduttori digiti minimi (ulnare) e per la conduzione sensoriale dal polso a D2 (mediana) e D5 ( ulnare) rispetto a ciascun nervo contralesionale non danneggiato di ciascun paziente. Su nove, sette pazienti avevano transezioni che includevano il nervo mediano. Di questi sette, un paziente non ha avuto risposta rilevabile durante i test motori e un altro paziente non ha avuto risposta rilevabile durante i test sensoriali.
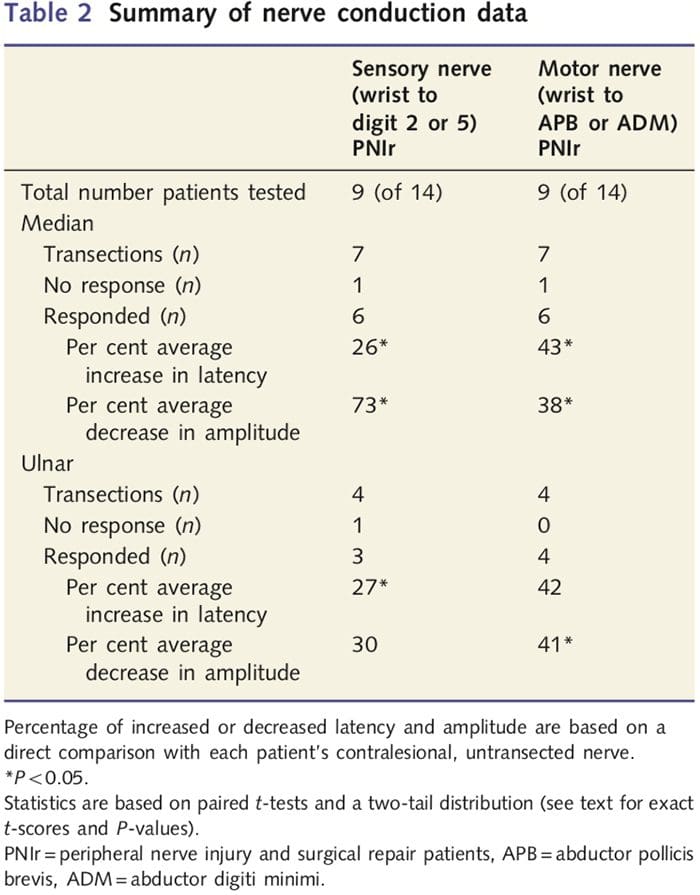 Nei sei pazienti con risposte rilevabili, le latenze della conduzione motoria erano aumentate del 43% (t = 6.2; P = 0.002) e le ampiezze erano diminuite del 38% (t = 2.6; P = 0.045) quando il nervo sezionato di ogni paziente era rispetto al loro lato non ferito. La conduzione sensoriale nei nervi mediani ha anche rivelato un aumento del 26% della latenza (t = 3.9; P = 0.011) e una diminuzione del 73% dell'ampiezza (t = 8.0; P = 0.000) rispetto ai normali nervi contralesionali. Nei quattro pazienti con transezioni del nervo ulnare un paziente non ha avuto una risposta rilevabile durante il test del nervo sensoriale. In quei pazienti con risposte, le latenze motorie del nervo ulnare non erano significativamente elevate (t = 2.8; P = 0.070); tuttavia, le ampiezze erano significative
Nei sei pazienti con risposte rilevabili, le latenze della conduzione motoria erano aumentate del 43% (t = 6.2; P = 0.002) e le ampiezze erano diminuite del 38% (t = 2.6; P = 0.045) quando il nervo sezionato di ogni paziente era rispetto al loro lato non ferito. La conduzione sensoriale nei nervi mediani ha anche rivelato un aumento del 26% della latenza (t = 3.9; P = 0.011) e una diminuzione del 73% dell'ampiezza (t = 8.0; P = 0.000) rispetto ai normali nervi contralesionali. Nei quattro pazienti con transezioni del nervo ulnare un paziente non ha avuto una risposta rilevabile durante il test del nervo sensoriale. In quei pazienti con risposte, le latenze motorie del nervo ulnare non erano significativamente elevate (t = 2.8; P = 0.070); tuttavia, le ampiezze erano significative
è diminuito del 41% (t = �5.9; P = 0.010). I test sensoriali del nervo ulnare hanno dimostrato un aumento del 27% della latenza (t = 4.3; P = 0.049) ma nessun aumento significativo dell'ampiezza (t = 3.5; P = 0.072).
Plasticità funzionale nella corteccia somatosensoriale primaria
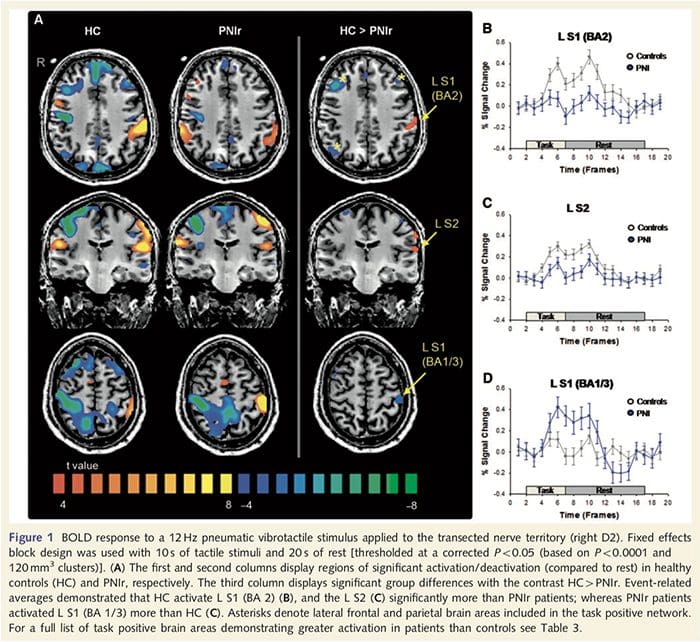
Le mappe MRI funzionali sono state calcolate dagli 11 pazienti PNIr con transezioni del nervo mediano destro (i pazienti con transezioni del nervo ulnare sono stati esclusi da questa analisi) e 11 controlli sani abbinati per età e sesso. Dalla Fig. 1A, è chiaro che i pazienti PNIr hanno un'attivazione significativamente inferiore, rispetto ai controlli sani, in una regione di S1 corrispondente all'area di Brodmann 2 (BA2) (Talairach e Tournoux, 1988) e S2 (vedere la Tabella 3 per i dettagli) . Le risposte medie correlate all'evento da queste regioni di interesse evidenziano la risposta BOLD attenuata all'interno del BA2 sinistro e S2 sinistro dei pazienti (Fig. 1B e C, rispettivamente). Curiosamente, la stimolazione vibrotattile nei pazienti ha attivato una parte più superiore del giro post-centrale (probabilmente BA1 / 3) (Talairach e Tournoux, 1988) (Fig. 1A e Tabella 3). Una media correlata agli eventi (Fig. 1D) dimostra che i controlli sani avevano un'attivazione minima in questa regione. Inoltre, i pazienti avevano un'attivazione significativamente maggiore nelle regioni del cervello note collettivamente come rete di attività positiva (asterischi in Fig. 1). Vedere la Tabella 3 per l'elenco completo delle aree cerebrali positive per attività attivate. Questa rete include cortecce laterale prefrontale, parietale laterale, premotoria e temporale inferiore (Tabella 3): aree cerebrali che vengono attivate durante l'esecuzione di un compito che richiede attenzione e soppresse o inattive durante il riposo o attività che non sono cognitivamente o attenzionalmente impegnative (Fox et al., 2005; DeLuca et al., 2006; Seminowicz e Davis 2007).
La materia grigia ridotta nella corteccia somatosensoriale primaria è correlata al recupero sensoriale
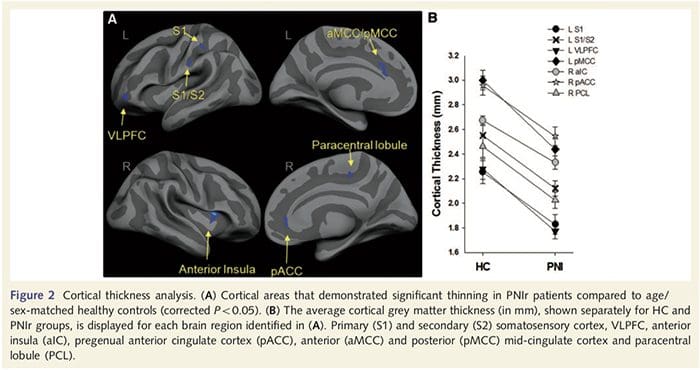
L'analisi dello spessore corticale in tutti i 14 pazienti e nei 14 controlli sani abbinati per età / sesso ha rivelato diversi loci di assottigliamento corticale significativo nel gruppo PNIr (Fig. 2 e Tabella 4). In particolare, i pazienti avevano una riduzione del 13% -22% dello spessore corticale in S1, S2 sinistro (contralesionale), giro cingolato anteriore pregenuale, corteccia prefrontale ventrolaterale e isola anteriore destra, giro cingolato medio anteriore / posteriore e lobulo paracentrale. È interessante notare che le posizioni dell'assottigliamento della materia grigia all'interno del giro post-centrale coincidono con le regioni di BOLD ridotto a seguito della stimolazione vibrotattile (Tabella 4). Poiché avevamo una conoscenza preliminare dei deficit sensoriali dei pazienti e del tempo di recupero (cioè il tempo trascorso dalla riparazione microchirurgica), ci siamo quindi chiesti se lo spessore corticale dei pazienti nel giro post-centrale fosse correlato alle loro soglie di rilevamento meccanico e vibratorio sensoriale o con le loro i tempi di recupero. Queste analisi hanno rivelato una correlazione negativa tra lo spessore corticale e le soglie di rilevamento delle vibrazioni in una regione che comprende BA1 / 2 e S2 (P50.001, r =? 0.80 e? 0.91, rispettivamente per BA1 / 2 e S2; Fig.3 e Tabella 5 ). Inoltre, le soglie di rilevamento meccanico erano anche correlate negativamente con lo spessore corticale in una regione BA2 leggermente più superiore e nella stessa regione S2 (P50.001, r =? 0.83 e? 0.85, per BA2 e S2, rispettivamente; Fig.3 e Tabella 5). Tuttavia, non abbiamo identificato una relazione significativa tra tempo di recupero e spessore corticale. Pertanto, nel giro post-centrale l'assottigliamento corticale era associato a deficit sensoriali più gravi. Tuttavia, non abbiamo identificato una relazione significativa tra tempo di recupero e spessore corticale. Anche in questo caso, c'era una corrispondenza tra l'assottigliamento corticale in aree negativamente correlate con stimoli vibratori e le regioni che mostravano anomalie fMRI e CTA di gruppo.
Anomalie della materia bianca dopo la transizione nervosa
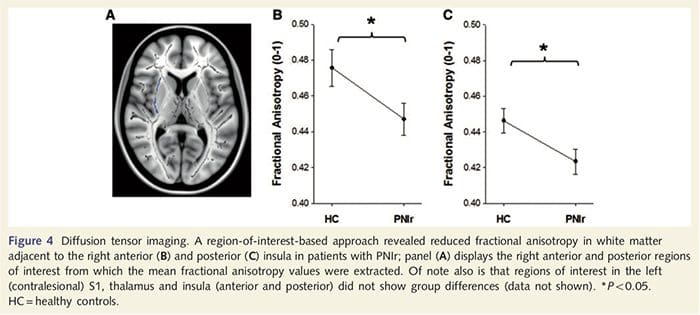
Per valutare l'integrità della materia bianca abbiamo utilizzato un approccio di area di interesse per esaminare le differenze dei gruppi di materia bianca sulla base di ipotesi a priori. Le regioni di interesse erano limitate a tratti di materia bianca che circondavano e alimentavano il controsional S1 e il talamo. Inoltre, abbiamo anche disegnato regioni di interesse per la sostanza bianca adiacente all'insula sinistra e destra, anteriore e posteriore. L'insula è stata scelta in quanto è implicata nell'elaborazione somatosensoriale e perché abbiamo identificato una riduzione della materia grigia nell'insula anteriore destra con CTA. Questo approccio alla regione di interesse ha rivelato che i pazienti avevano significativamente ridotto i valori di anisotropia frazionale della materia bianca (MANOVA incluse tutte e sei le regioni di interesse) adiacenti alla destra anteriore [F (1, 26) = 4.39, P = 0.046; Fig. 4A] e insula posteriore [F (1, 26) = 5.55, P = 0.026; Fig. 4B], ma non vi erano differenze di gruppo nella materia bianca adiacente all'insula sinistra (insula anteriore sinistra: P = 0.51; insula posteriore sinistra: P = 0.26), talamo (P = 0.46) o S1 (P = 0.46 ).
 Discussione
Discussione
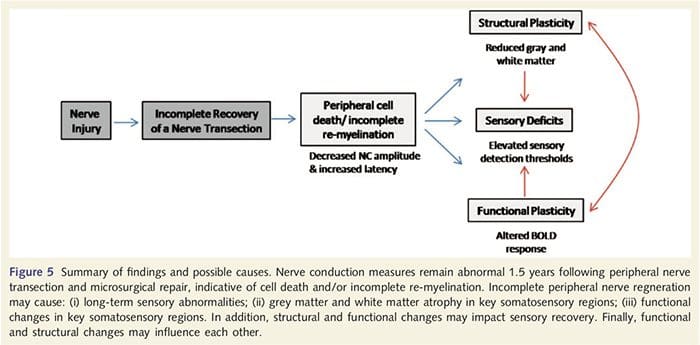
Qui, abbiamo dimostrato per la prima volta che esiste plasticità funzionale e anomalie strutturali sia della materia grigia che della materia bianca in diverse aree corticali dopo la transezione dei nervi periferici dell'arto superiore e la riparazione chirurgica. Questa plasticità può derivare dalla rigenerazione incompleta dei nervi periferici (morte delle cellule periferiche e / o mielinizzazione incompleta), poiché le misure di conduzione nervosa in questi pazienti hanno dimostrato gravi anomalie. Inoltre, i nostri dati dimostrano che le diminuite risposte fMRI evocate dal vibrotattile nel giro post-centrale corrispondono al diradamento della sostanza grigia nel gruppo di pazienti. Questi risultati suggeriscono che una riduzione delle risposte BOLD può essere facilitata da una riduzione della sostanza grigia corticale e / o una diminuzione del contributo afferente al giro post-centrale. Inoltre, lo spessore corticale all'interno di queste stesse parti del giro post-centrale era correlato negativamente con le misure comportamentali della funzione somatosensoriale. Cioè, l'aumento dei deficit somatosensoriali era correlato alla corteccia più sottile; entrambi i quali possono essere correlati a input afferenti. Presi insieme, i nostri dati suggeriscono che la rigenerazione incompleta dei nervi periferici contribuisce a compromettere la somatosensoria, atrofia corticale della materia grigia e ridotta attivazione della risonanza magnetica funzionale (vedi Fig. 5 per un riassunto di questi risultati).
È noto che la plasticità corticale dopo la transezione dei nervi periferici e la riparazione chirurgica può verificarsi in tutto il sistema nervoso centrale nei primati non umani (Kaas, 1991). Si ritiene che questa plasticità sia dovuta allo smascheramento delle sinapsi precedentemente silenti o del germogliamento assonale in territorio non controllato (Wall et al., 1986; Florence and Kaas, 1995). Nel modello dei primati, l'anno 1 dopo la transezione nervosa e la riparazione chirurgica, la corteccia denervata è caratterizzata da rappresentazioni incomplete e disordinate dei nervi rigenerati e adiacenti (intatti). Questa rappresentazione frammentaria è attribuita alla rigenerazione periferica incompleta che ha come conseguenza un recupero parziale dello spazio corticale denervato (Kaas, 1991). Per valutare l'entità della rigenerazione periferica nella nostra popolazione di pazienti abbiamo eseguito studi di conduzione del nervo sensoriale e motorio attraverso l'area transezionata. I nostri risultati di conduzione nervosa dimostrano che i pazienti con PNIr hanno un'ampiezza significativamente diminuita e una maggiore latenza nei nervi sia sensoriali che motori rispetto al loro lato non trattato. Una diminuzione dell'ampiezza combinata con una maggiore latenza è indicativa della perdita delle fibre periferiche (cioè morte cellulare) e / o della mielinizzazione anomala o incompleta dopo la transezione (Kimura, 1984). Inoltre, è ben noto che tra 20% e 50% di neuroni del ganglio della radice dorsale muoiono dopo la transezione del nervo (Liss et al., 1996). Pertanto, la morte cellulare afferente e la rigenerazione incompleta possono comportare una riduzione dell'ingresso afferente alla corteccia, che può spiegare i deficit sensoriali in corso e la diminuzione della risposta BOLD in BA2 e S2. Inoltre, questo diminuito input afferente potrebbe anche spiegare il diradamento corticale che abbiamo osservato nelle stesse regioni della corteccia. È stato dimostrato che la deprivazione sensoriale causa degenerazione trans-neuronale in diverse regioni del sistema nervoso centrale, tra cui il corno dorsale che segue la sezione del nervo sciatico (Knyihar-Csillik et al., 1989) e può coinvolgere neuroni del secondo e terzo ordine (Powell e Erulkar, 1962). La degenerazione transneuronale è caratterizzata da restringimento cellulare e si ritiene che sia correlata a un input afferente in diminuzione, o inesistente (Knyihar-Csillik et al., 1989). Pertanto, la perdita di materia grigia corticale (o atrofia) potrebbe anche essere direttamente correlata alla diminuzione dell'ingresso afferente.
 Abbiamo anche dimostrato una maggiore attivazione nel giro post-centrale in una regione corrispondente a BA1 / 3 (Talairach e Tournoux, 1988). Studi elettrofisiologici, di tracciamento anatomico e di neuroimaging hanno stabilito che per la maggior parte delle afferenze meccanorecettive cutanee le prime destinazioni corticali sono BA1 e BA3b. Queste aree del cervello citoarchitettonico possiedono ciascuna una mappa corporea somatotopica con piccoli campi ricettivi. Inoltre, queste aree rispondono a molte caratteristiche delle informazioni tattili, come consistenza e rugosità, velocità e curvatura degli stimoli (Bodegard et al., 2001). Gli studi di risonanza magnetica hanno dimostrato che l'attività all'interno della corteccia somatosensoriale è influenzata da un'attenzione tale che le risposte fMRI agli stimoli tattili in S1 aumentano quando i soggetti partecipano a uno stimolo tattile, ma sono atterrite quando i soggetti sono distratti (Arthurs et al., 2004; Porro et al., 2004). Inoltre, i nostri pazienti hanno attivato una rete di aree cerebrali conosciute come la rete di attività positiva (DeLuca et al., 2006) più che controlli sani. Queste aree cerebrali vengono attivate durante i processi di attenzione (Fox et al., 2005; Seminowicz e Davis, 2007). Insieme, questi risultati implicano che i pazienti devono prestare attenzione allo stimolo più che ai controlli a causa del loro apporto sensoriale alterato. Questa maggiore attenzione può anche spiegare l'aumento dell'attivazione in BA1 / 3b. Ovviamente, l'aumento dell'attivazione in BA1 / 3b può anche riflettere la plasticità che non è correlata al carico attenzionale.
Abbiamo anche dimostrato una maggiore attivazione nel giro post-centrale in una regione corrispondente a BA1 / 3 (Talairach e Tournoux, 1988). Studi elettrofisiologici, di tracciamento anatomico e di neuroimaging hanno stabilito che per la maggior parte delle afferenze meccanorecettive cutanee le prime destinazioni corticali sono BA1 e BA3b. Queste aree del cervello citoarchitettonico possiedono ciascuna una mappa corporea somatotopica con piccoli campi ricettivi. Inoltre, queste aree rispondono a molte caratteristiche delle informazioni tattili, come consistenza e rugosità, velocità e curvatura degli stimoli (Bodegard et al., 2001). Gli studi di risonanza magnetica hanno dimostrato che l'attività all'interno della corteccia somatosensoriale è influenzata da un'attenzione tale che le risposte fMRI agli stimoli tattili in S1 aumentano quando i soggetti partecipano a uno stimolo tattile, ma sono atterrite quando i soggetti sono distratti (Arthurs et al., 2004; Porro et al., 2004). Inoltre, i nostri pazienti hanno attivato una rete di aree cerebrali conosciute come la rete di attività positiva (DeLuca et al., 2006) più che controlli sani. Queste aree cerebrali vengono attivate durante i processi di attenzione (Fox et al., 2005; Seminowicz e Davis, 2007). Insieme, questi risultati implicano che i pazienti devono prestare attenzione allo stimolo più che ai controlli a causa del loro apporto sensoriale alterato. Questa maggiore attenzione può anche spiegare l'aumento dell'attivazione in BA1 / 3b. Ovviamente, l'aumento dell'attivazione in BA1 / 3b può anche riflettere la plasticità che non è correlata al carico attenzionale.
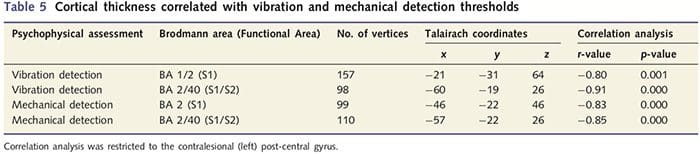
 BA2 e S2 ricevono entrambi proiezioni da BA1 / 3b e anche da parti distinte del complesso talamico ventroposteriore (Pons et al., 1985; Friedman and Murray, 1986). Entrambi cervello aree hanno campi recettivi ampi, spesso a più cifre (BA2) o bilaterali (S2) (Pons et al., 1985; Iwamura et al., 2002). Sulla base di proiezioni anatomiche e proprietà di risposta neuronale, l'elaborazione gerarchica delle informazioni tattili è stata dimostrata da BA1 / 3b a BA 2 (Kaas et al., 2002). Inoltre, studi elettrofisiologici sui macachi (Pons et al., 1987) e dati magnetoencefalografici acquisiti nell'uomo, suggeriscono che l'elaborazione seriale degli input tattili si verifica da S1 a S2 nei primati superiori (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Diversi studi hanno dimostrato che BA2 è attivato preferenzialmente dalla forma e dalla curvatura (Bodegard et al., 2001), mentre S2 può essere coinvolto nell'apprendimento tattile (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), supportando l'idea che queste aree del cervello sono coinvolti nell'elaborazione somatosensoriale di ordine superiore. La nostra valutazione psicofisica ha dimostrato che i pazienti erano significativamente compromessi nel rilevamento di semplici stimoli tattili e nel test di identificazione della struttura della forma 1.5 anni dopo l'intervento chirurgico (Taylor et al., 2008a). Quest'ultimo test valuta la capacità di un paziente di riconoscere le caratteristiche di un oggetto mentre esplora attivamente una forma o una struttura, richiedendo l'integrazione di informazioni sensoriali attraverso le regioni del corpo (Rosen e Lundborg, 1998). Nel loro insieme, un'interpretazione dei nostri dati è che i pazienti con PNIr prestano più attenzione allo stimolo vibrotattile, portando ad una maggiore attivazione della rete task positive e BA1 / 3. Tuttavia, in questi pazienti, i nostri dati implicano che le aree di elaborazione di ordine superiore, come BA2 e S2, non hanno ricevuto informazioni tattili, il che, a sua volta, può provocare un assottigliamento corticale e una riduzione delle risposte BOLD.
BA2 e S2 ricevono entrambi proiezioni da BA1 / 3b e anche da parti distinte del complesso talamico ventroposteriore (Pons et al., 1985; Friedman and Murray, 1986). Entrambi cervello aree hanno campi recettivi ampi, spesso a più cifre (BA2) o bilaterali (S2) (Pons et al., 1985; Iwamura et al., 2002). Sulla base di proiezioni anatomiche e proprietà di risposta neuronale, l'elaborazione gerarchica delle informazioni tattili è stata dimostrata da BA1 / 3b a BA 2 (Kaas et al., 2002). Inoltre, studi elettrofisiologici sui macachi (Pons et al., 1987) e dati magnetoencefalografici acquisiti nell'uomo, suggeriscono che l'elaborazione seriale degli input tattili si verifica da S1 a S2 nei primati superiori (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Diversi studi hanno dimostrato che BA2 è attivato preferenzialmente dalla forma e dalla curvatura (Bodegard et al., 2001), mentre S2 può essere coinvolto nell'apprendimento tattile (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), supportando l'idea che queste aree del cervello sono coinvolti nell'elaborazione somatosensoriale di ordine superiore. La nostra valutazione psicofisica ha dimostrato che i pazienti erano significativamente compromessi nel rilevamento di semplici stimoli tattili e nel test di identificazione della struttura della forma 1.5 anni dopo l'intervento chirurgico (Taylor et al., 2008a). Quest'ultimo test valuta la capacità di un paziente di riconoscere le caratteristiche di un oggetto mentre esplora attivamente una forma o una struttura, richiedendo l'integrazione di informazioni sensoriali attraverso le regioni del corpo (Rosen e Lundborg, 1998). Nel loro insieme, un'interpretazione dei nostri dati è che i pazienti con PNIr prestano più attenzione allo stimolo vibrotattile, portando ad una maggiore attivazione della rete task positive e BA1 / 3. Tuttavia, in questi pazienti, i nostri dati implicano che le aree di elaborazione di ordine superiore, come BA2 e S2, non hanno ricevuto informazioni tattili, il che, a sua volta, può provocare un assottigliamento corticale e una riduzione delle risposte BOLD.
Si ritiene che l'insula svolga un ruolo nell'integrazione di informazioni multimodali importanti per funzioni sensomotorie, emotive, allostatiche / omeostatiche e cognitive (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) ed è stata designata una corteccia sensica limbica (Craig , 2008). Diversi studi hanno riportato attivazione insulare in risposta alla stimolazione tattile (Gelnar et al., 1998;
Downar et al., 2002) e studi di tracciamento anatomico nei primati hanno dimostrato che l'insula è reciprocamente connessa ai lobi frontali, parietali e temporali (Agostino, 1996). Nei nostri pazienti, l'insula anteriore destra era l'unica area corticale che ha dimostrato un assottigliamento corticale significativo in combinazione con valori ridotti di anisotropia frazionaria nella sostanza bianca adiacente, suggerendo che il diradamento corticale all'interno di questa regione è associato a una perdita di fibre proiettate da o verso questa struttura. L'insula anteriore destra è stata implicata nell'interocezione in quanto situata per integrare l'input omeostatico dal corpo con condizioni motivazionali, emotive e sociali (Craig, 2008). Inoltre, Critchley et al. (2004) ha riportato una correlazione tra le capacità interocettive e il volume della materia grigia dell'insula anteriore destra. Data la nostra scoperta che i pazienti hanno una diminuzione della materia grigia nell'insula anteriore destra, sarebbe interessante valutare le capacità interocettive in seguito a lesioni dei nervi periferici in uno studio futuro.
Presi insieme, abbiamo dimostrato per la prima volta che alterazioni funzionali e strutturali sono presenti nella corteccia cerebrale umana 1.5 anni dopo una completa trasfezione di un nervo periferico dell'arto superiore che è stato riparato in modo microchirurgico. Inoltre, le misure di conduzione nervosa indicano una rigenerazione periferica incompleta in questi pazienti. Inoltre, dimostriamo che lo spessore corticale è correlato a misure psicofisiche di recupero, in quanto la corteccia più sottile all'interno di BA2 e S2 era associata a una funzione somatosensoriale più povera. Questi dati suggeriscono che il ripristino delle normali mappe di attivazione funzionale è direttamente associato alla rigenerazione di successo delle afferenze periferiche.
Keri S. Taylor, 1,2 Dimitri J. Anastakis2,3,4 e Karen D. Davis1,2,3
1 Divisione di Brain, Imaging and Behavior Systems Neuroscience, Toronto Western Research Institute, University Health Network, Toronto, Canada M5T258
2 Institute of Medical Science, Università di Toronto, Canada
3 Dipartimento di Chirurgia, Università di Toronto, Canada
Centro risorse 4 per studi clinici, Toronto Western Research Institute, University Health Network, Toronto, Canada M5T2S8
Corrispondenza a: Karen D. Davis, Ph.D.,
Divisione di Brain, Imaging and Behavior Systems Neuroscience, Toronto Western Research Institute,
Ospedale Occidentale di Toronto,
Rete sanitaria universitaria,
Camera MP14-306, 399 Bathurst Street,
Toronto, Ontario,
Canada M5T 2S8
E-mail: kdavis@uhnres.utoronto.ca
Ringraziamenti
Gli autori ringraziano Mr. Geoff Pope, Dr. Adrian Crawley, Mr. Eugene Hlasny e Mr. Keith Ta per l'assistenza tecnica esperta. Gli autori desiderano ringraziare il Dott. Peter Ashby e il Sig. Freddy Paiz della Clinica EMG dell'Ospedale Occidentale di Toronto per condurre i test di conduzione nervosa e per fornire una valutazione esperta dei risultati. Gli autori ringraziano anche i dott. Dvali, Binhammer, Fialkov e Antonyshyn per aver collaborato a questo progetto. Il Dott. Davis è una cattedra di ricerca del Canada in Brain and Behavior (CIHR MOP 53304).
Finanziamento
The Physicians Services Incorporated e una borsa di studio congiunta dell'Università di Toronto Centre for the Study of Pain / AstraZeneca.
Materiale supplementare
Il materiale supplementare è disponibile su Brain online.
vuoto
Riferimenti:
Apkarian AV, Sosa Y, Sonty S, et al. Il mal di schiena cronico è associato a
diminuzione della densità della materia grigia prefrontale e talamica. J Neurosci
2004; 24: 10410 5.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Attenzione
modula in modo differenziale l'accoppiamento di fMRI BOLD ed evocato
ampiezze potenziali del segnale nella corteccia somatosensoriale umana 7.
Exp Brain Res 2004; 157: 269.
Augustine JR. Circuiti e aspetti funzionali del lobo insulare
nei primati compreso l'uomo. Brain Res Brain Res Rev 1996; 22:
229 44.
Beaulieu C. La base della diffusione dell'acqua anisotropa nel nervo
sistema - una revisione tecnica. NMR Biomed 2002; 15: 435 55.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Gerarchico
elaborazione della forma tattile nel cervello umano. Neuron 2001; 31:
317 28.
Craig AD. Interocezione ed emozione: una prospettiva neuroanatomica.
In: Lewis M, Haviland-Jones J, Barrett L, editori. Manuale di
emozioni. New York: Guildford Press; 2008. p. 272 87.
Critchley HD. La corteccia umana risponde a una sfida interocettiva.
Proc Natl Acad Sci USA 2004; 101: 6333 4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Sistemi neurali
sostenere la consapevolezza interocettiva. Nat Neurosci 2004; 7: 189.
Dale AM, Fischl B, Sereno MI. Analisi basata sulla superficie corticale. I. Segmentazione
e ricostruzione superficiale. Neuroimage 1999; 9: 179 94.
Davis KD, Papa G, Chen J, Kwan CL, Crawley AP, Diamant NE. Corticale
assottigliamento in IBS: implicazioni per omeostatica, attenzione e dolore
in lavorazione. Neurology 2008; 70: 153.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI a riposo
le reti statali definiscono modalità distinte di interazioni a lunga distanza
nel cervello umano. Neuroimage 2006; 29: 1359 67.
Devinsky O, Morrell MJ, Vogt BA. Contributi del cingolato anteriore
corteccia al comportamento. Brain 1995; 118 (Pt 1): 279-306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Evidence for interemisferico
elaborazione degli input dalle mani in S2 umano
e PV. J Neurophysiol 2001; 85: 2236.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Una rete corticale sensibile
per stimolare salienza in un contesto comportamentale neutro attraverso più
modalità sensoriali. J Neurophysiology 2002; 87: 615 20.
Draganski B, Moser T, Lummel N, et al. Diminuzione del grigio talamico
materia dopo l'amputazione di un arto. Neuroimage 2006; 31: 951 7.
Fischl B, Dale AM. Misurazione dello spessore della corteccia cerebrale umana
da immagini di risonanza magnetica. Proc Natl Acad Sci USA 2000; 97:
11050 5.
Fischl B, Sereno MI, Dale AM. Analisi basata sulla superficie corticale. II:
Inflazione, appiattimento e sistema di coordinate basato sulla superficie.
Neuroimage 1999a; 9: 195-207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Intersoggetto ad alta risoluzione
media e un sistema di coordinate per la superficie corticale. Hum Brain
Mapp 1999b; 8: 272.
Florence SL, Kaas JH. Riorganizzazione su larga scala a più livelli di
la via somatosensoriale segue l'amputazione terapeutica della mano
nelle scimmie. J Neurosci 1995; 15: 8083 95.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. Il
il cervello umano è intrinsecamente organizzato in dinamico, anticorrelato
reti funzionali. Proc Natl Acad Sci USA 2005; 102: 9673 9678.
Friedman DP, Murray EA. Connettività talamica del secondo
area somatosensoriale e vicini campi somatosensoriali del
solco laterale del macaco. J Comp Neurol 1986; 252: 348.
Frot M, Mauguiere F. Timing e distribuzione spaziale del somatosensoriale
risposte registrate nella sponda superiore della fessura silviana (area SII) in
gli esseri umani. Cereb Cortex 1999; 9: 854 63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
Il cervello nel dolore CRPS cronico: sostanza grigia-bianca anormale
interazioni nelle regioni emotive e autonome. Neuron 2008; 60:
570 81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Rappresentazione della punta delle dita
nella corteccia somatosensoriale umana: uno studio fMRI.
Neuroimage 1998; 7: 261.
Hickmott PW, Steen PA. Cambiamenti su larga scala nella struttura dendritica
durante la riorganizzazione della corteccia somatosensoriale dell'adulto. Nat Neurosci
2005; 8: 140 42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Processing of
segnali tattili e cinestetici dai lati bilaterali del corpo in
giro postcentrale di scimmie sveglie. Behav Brain Res 2002; 135:
185 90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Lesioni del nervo mediano, ulnare e combinato mediano-ulnare: funzionali
risultato e ritorno alla produttività. J Trauma 2001; 51: 687 92.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Atrofia corticale somatosensoriale dopo lesione del midollo spinale: a voxelbased
studio della morfometria. Neurology 2006; 66: 762.
Kaas JH. Plasticità delle mappe sensoriali e motorie nei mammiferi adulti. Annu
Rev Neurosci 1991; 14: 137.
Kaas JH, Jain N, Qi HX. L'organizzazione del sistema somatosensoriale in
primati. In: Nelson RJ, editore. Il sistema somatosensoriale.
Washington, DC: CRC Press; 2002. p. 1 25.
Kimura J. Elettrodiagnosi nelle malattie del nervo e del muscolo: principi
e pratica. Oxford: Oxford University Press; 2001.
Kimura J. Principi e insidie degli studi sulla conduzione nervosa. Ann Neurol
1984; 16: 415 29.
Knyihar-Csillik E, Rakic P, Csillik B.Degenerazione transneuronale in
la sostanza Rolando del midollo spinale primate evocata da
atrofia degenerativa della zona centrale transgangliare indotta da assotomia
terminali sensoriali primari. Cell Tissue Res 1989; 258: 515 25.
Liss AG, af Ekenstam FW, Wiberg M. Perdita di neuroni nella radice dorsale
gangli dopo la transezione di un nervo sensoriale periferico. Un anatomico
studiare nelle scimmie. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1 6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Phantom
e dolore. Uno studio fMRI su amputati degli arti superiori. Brain 2001;
124: 2268.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Seriale
fMRI dei cambiamenti adattativi nella corteccia sensomotoria primaria in seguito
ricostruzione del pollice. Neurology 2002; 59: 1278 81.
Può A. Il dolore cronico può modificare la struttura del cervello. Pain 2008;
137: 7.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. L'epidemiologia e
gestione delle lesioni dei nervi periferici degli arti superiori nella moderna
pratica. J Hand Surg (Br) 1996; 21: 4 13.
Murray EA, Mishkin M. Contributi relativi di SII e area5 al tattile
discriminazione nelle scimmie 2. Behav Brain Res 1984; 11: 67.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Plasticità corticale somatosensoriale nella sindrome del tunnel carpale: una sezione trasversale
valutazione fMRI. Neuroimage 2006; 31: 520-30.
Oldfield RC. La valutazione e l'analisi della manualità: l'Edinburgh
inventario. Neuropsychologia 1971; 9: 97 113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. L'organizzazione somatotopica
dell'area 2 nelle scimmie macaco 6. J Comp Neurol 1985; 241: 445.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Physiological evidence
per l'elaborazione seriale nella corteccia somatosensoriale. Science 1987; 237:
417 20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Attività relative a Percept
nel sistema somatosensoriale umano: risonanza magnetica funzionale
studi di imaging. Magn Reson Imaging 2004; 22: 1539 48.
Powell TP, Erulkar S. Degenerazione delle cellule transneuronali nell'udito
relè nuclei del gatto. J Anat 1962; 96: 249 68.
Ridley RM, Ettlinger G. Compromissione dell'apprendimento tattile e della ritenzione dopo
rimozioni della seconda corteccia di proiezione sensoriale somatica (SII) nel
scimmia. Brain Res 1976; 109: 656-60.
Rosen B, Lundborg G. Un nuovo strumento di gnosi tattile nella sensibilità
test. J Hand Ther 1998; 11: 251 7.
Seminowicz DA, Davis KD. Il dolore migliora la connettività funzionale
di una rete cerebrale evocata dall'esecuzione di un compito cognitivo.
J Neurophysiol 2007; 97: 3651 9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Spaziale basato su tratti
statistica: analisi voxelwise di dati di diffusione multi-soggetto.
Neuroimage 2006; 31: 1487.
Talairach J, Tournoux P. Atlante stereotassico complanare del cervello umano.
New York: Thieme Medical Publishers Inc .; 1988.
Taylor KS, Anastakis DJ, Davis KD. Dolore cronico in seguito periferico
la lesione nervosa è associata a dolore catastrofico e nevroticismo.
Int Ass Stud Pain 2008a; 267.
Taylor KS, Davis KD. Stabilità della fMRI tattile e correlata al dolore
attivazioni cerebrali: un esame della soglia dipendente e
metodi indipendenti dalla soglia. Hum Brain Mapp 2009; 30:
1947 62.
Taylor KS, Seminowicz DA, Davis KD. Due sistemi di stato di riposo
connettività tra l'insula e la corteccia cingolata. Hum Brain
Mapp 2008b; DOI: 10.1002 / hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Riorganizzazione funzionale nelle aree corticali somatosensoriali 3b e 1
di scimmie adulte dopo la riparazione del nervo mediano: possibile relazione con
recupero sensoriale negli esseri umani. J Neurosci 1986; 6: 218.





