by spinedoctors | Neurofisiologia clinica
Epigenetic: Esiste una bella interazione tra l'esperienza sensoriale e i programmi genetici innati che portano alla scolpitura dei circuiti neuronali durante lo sviluppo iniziale del cervello. Prove recenti suggeriscono che la regolazione dinamica dell'espressione genica attraverso meccanismi epigenetici sia all'interfaccia tra stimoli ambientali e fenotipi comportamentali molecolari, cellulari e complessi di lunga durata acquisiti durante periodi di plasticità dello sviluppo. La comprensione di questi meccanismi può fornire informazioni sulla formazione di periodi critici e fornire nuove strategie per aumentare la plasticità e i cambiamenti adattativi nell'età adulta.
Introduzione
Durante lo sviluppo iniziale, vengono creati circuiti neuronali e le connessioni tra i neuroni subiscono un rimodellamento mentre sviluppano le loro proprietà funzionali adulte in risposta all'ambiente circostante. Il cervello adulto perde questa straordinaria plasticità. Recenti scoperte supportano un ruolo chiave di fattori epigenetici nel mediare gli effetti dell'esperienza sensoriale sull'espressione genica site-specific, sulla trasmissione sinaptica e sui fenotipi comportamentali. Qui passiamo in rassegna le prove recenti che implicano molteplici meccanismi epigenetici nei cambiamenti dipendenti dall'esperienza durante lo sviluppo e discutiamo il loro ruolo nell'espressione del periodo critico nel cervello in via di sviluppo e adulto.
Epigenetica: Meccanismi molecolari del regolamento genico
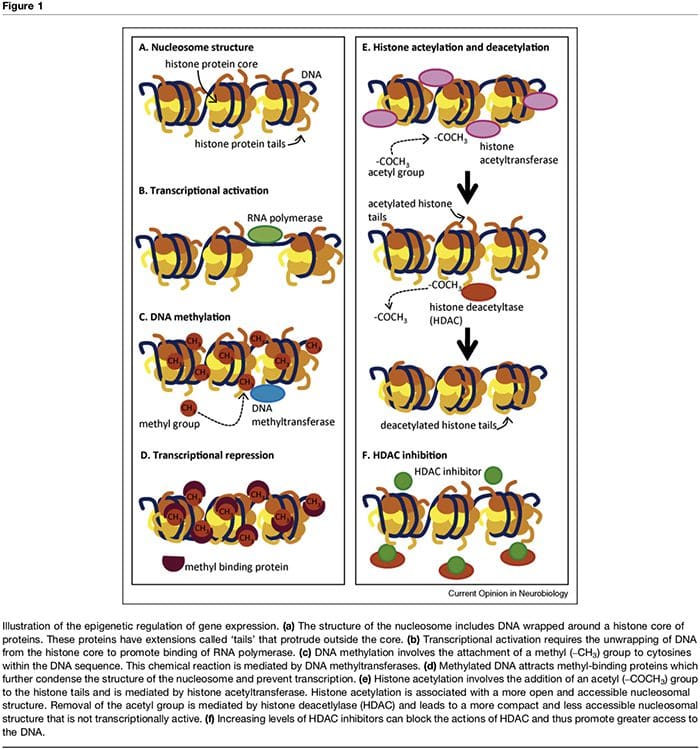
Il termine "epigenetico" si riferisce alle modificazioni della cromatina che alterano l'espressione genica senza influenzare la sequenza del DNA. I fattori che contribuiscono alla regolazione epigenetica dell'attività trascrizionale sono numerosi e comprendono microRNA [1], metilazione del DNA [2,3] e modificazioni post-traduzionali degli istoni nucleosomiali [2,4]. La metilazione del DNA si riferisce a una modifica chimica del DNA mediante la quale la citosina viene convertita in 5-metilcitosina con la conseguenza di una ridotta accessibilità del DNA ai fattori di trascrizione (Figura 1a d). Queste modifiche possono essere stabili ed ereditabili e fornire un meccanismo critico nella differenziazione cellulare [3]. Il processo di metilazione dipende dalla presenza di donatori di metile (forniti da nutrienti come acido folico, metionina e colina) e metiltransferasi che mediano il mantenimento (es. DNMT1) o la metilazione de novo del DNA (es. DNMT3). La repressione trascrizionale associata alla metilazione del DNA è ulteriormente sostenuta attraverso proteine leganti metile come MeCP2 [5]. Il controllo epigenetico dell'espressione genica è anche mediato da più modifiche post-traduzionali delle proteine istoniche, tra cui metilazione, acetilazione e ubiquinazione, che possono alterare l'accessibilità del DNA e la densità della struttura della cromatina (Figura 1e, f). In particolare, l'acetilazione dell'istone è associata ad una maggiore attività trascrizionale mentre la deacetilazione dell'istone è associata alla repressione trascrizionale. Lo stato di acetilazione di queste proteine nucleosomiali è controllato dalla presenza di istone acetiltransferasi (HAT), istone deacetilasi (HDAC), che vengono reclutate dalle proteine leganti il metile e dagli inibitori HDAC, che aumentano efficacemente l'espressione genica spostando gli istoni in un acetilato stato [2,6]. I tempi e il grado di espressione genica sono controllati attraverso questi meccanismi complessi, fornendo così un collegamento tra singoli genotipi e più fenotipi.
Fattori epigenetici e influenza delle prime esperienze di vita
Nello sviluppo dei mammiferi, i periodi prenatale e postnatale sono caratterizzati da rapidi cambiamenti nell'organizzazione neuronale, fornendo così una finestra critica di opportunità durante la quale le esperienze ambientali possono portare a influenze a lungo termine sul cervello e sul comportamento. Vi sono prove crescenti del ruolo dei fattori epigenetici nel mediare la relazione tra queste esperienze e gli esiti a lungo termine. Mueller e Bale [7] hanno recentemente dimostrato una diminuzione della metilazione del DNA del promotore del gene del fattore di rilascio della corticotropina (CRF) e un aumento della metilazione della regione promotore 17 dell'esone del recettore glucocorticoide (GR) nel tessuto ipotalamico di topi maschi adulti nati da femmine sottoposte a stress gestazionale . Queste modificazioni epigenetiche sono associate all'esposizione a stress durante le prime fasi dello sviluppo prenatale e possono comportare la disregolazione dell'espressione genica placentare. Il nutrizionale è stato anche dimostrato che l'ambiente durante lo sviluppo fetale influenza la crescita, il metabolismo e lo sviluppo del cervello e vi sono prove crescenti che i livelli dietetici dei donatori di metile possono alterare epigeneticamente l'espressione genica nella prole [8,9]. Nei ratti, Lillycrop et al. [10] illustra che GR 110 e PPARa (alfa del recettore attivato dal proliferatore attivato dal perossido) metilazione è ridotta nel tessuto epatico della prole nata da dighe a proteine limitate mentre la metilazione è aumentata nella prole di madri la cui dieta è integrata con donatori metilici [10,11 ]. Questi effetti possono essere correlati all'espressione di DNMT1, che è parimenti ridotta con la restrizione proteica della dieta [11]. Analogamente, la regolazione nutrizionale prenatale della metilazione del DNA è stata osservata nel tessuto cerebrale associato ai livelli di espressione di DNMT1 [12], suggerendo che nel periodo rapido di divisione cellulare durante lo sviluppo fetale, il livello dei donatori metilici può avere un impatto significativo sull'attività trascrizionale che viene mantenuto nell'età adulta.
 Il ruolo della modificazione epigenetica nel sostenere gli effetti dell'esperienza ambientale è stato dimostrato anche nel contesto delle interazioni madre-bambino postnatale. Variazioni individuali nell'assistenza materna durante l'immediato periodo postpartum nei ratti sono associate a cambiamenti nell'attività ipotalamo-ipofisi-surrene (HPA) della prole, nei sistemi neuroendocrini coinvolti nella riproduzione e nella plasticità ippocampale [13]. Le analisi dei livelli di metilazione del promotore all'interno dell'ippocampo GR 17 e dei geni ipotalamici ERa nella prole di madri di ratto che forniscono livelli alti rispetto a bassi di cura materna indicano che alti livelli di cura sono associati a una diminuzione della metilazione del promotore e quindi a una maggiore espressione genica [14,15, 17]. Sebbene il percorso attraverso il quale questi cambiamenti epigenetici siano mediati non è ancora chiaro, ci sono prove di un aumento del legame della proteina A inducibile dal fattore di crescita nervoso (NGFI-A) al promotore dell'esone 15 GR tra la prole che riceve alti livelli di cura durante l'infanzia [17] e modelli in vitro suggeriscono che l'up-regolazione dell'NGFI-A è associata all'acetilazione dell'istone, alla demetilazione del DNA e all'attivazione del promotore GR dell'esone 16 [17]. La rilevanza di questi effetti nell'uomo è stata recentemente dimostrata da Oberlander et al. [1] nell'analisi dello stato di metilazione del promotore GR nei siti di legame NGFI-A nelle cellule mononucleate del sangue del cordone ombelicale di neonati esposti a umore materno depresso o ansioso del terzo trimestre. È stato riscontrato che la depressione materna era associata ad un aumento della metilazione del promotore di GR 3F nei campioni di sangue fetale e questi modelli di metilazione predicevano la reattività HPA nei neonati a 17 mesi di età [1]. L'analisi del tessuto ippocampale di vittime di suicidio con una storia di abuso infantile indica analogamente una minore espressione di GR e una maggiore metilazione del promotore di GR 18F associata a interruzioni dell'ambiente precoce e conferma i risultati degli studi sui roditori che il legame differenziale di NGFI-A è una conseguenza funzionale di questi effetti epigenetici [19]. Tuttavia, l'impatto delle interazioni madre-bambino perinatali non è limitato alla regolazione della GR, come illustrato da Roth et al. [19] esaminando gli effetti dell'abuso postnatale sulla metilazione del fattore neurotrofico (BDNF) derivato dal cervello della prole [1]. Nei ratti, è stato riscontrato un aumento della metilazione dell'esone IV del promotore del BDNF e la conseguente diminuzione dell'mRNA del BDNF nella corteccia prefrontale in associazione con l'esposizione a periodi di cure materne abusive (trascinamento, manipolazione rude, ecc.). Come nel caso degli effetti delle differenze individuali nell'assistenza materna, questi effetti sono emersi nell'infanzia e sono stati mantenuti nell'età adulta. Inoltre, questi effetti sulla metilazione dell'esone IV del BDNF sono perpetuati nella generazione F20, suggerendo un ruolo per i meccanismi epigenetici negli effetti transgenerazionali [XNUMX].
Il ruolo della modificazione epigenetica nel sostenere gli effetti dell'esperienza ambientale è stato dimostrato anche nel contesto delle interazioni madre-bambino postnatale. Variazioni individuali nell'assistenza materna durante l'immediato periodo postpartum nei ratti sono associate a cambiamenti nell'attività ipotalamo-ipofisi-surrene (HPA) della prole, nei sistemi neuroendocrini coinvolti nella riproduzione e nella plasticità ippocampale [13]. Le analisi dei livelli di metilazione del promotore all'interno dell'ippocampo GR 17 e dei geni ipotalamici ERa nella prole di madri di ratto che forniscono livelli alti rispetto a bassi di cura materna indicano che alti livelli di cura sono associati a una diminuzione della metilazione del promotore e quindi a una maggiore espressione genica [14,15, 17]. Sebbene il percorso attraverso il quale questi cambiamenti epigenetici siano mediati non è ancora chiaro, ci sono prove di un aumento del legame della proteina A inducibile dal fattore di crescita nervoso (NGFI-A) al promotore dell'esone 15 GR tra la prole che riceve alti livelli di cura durante l'infanzia [17] e modelli in vitro suggeriscono che l'up-regolazione dell'NGFI-A è associata all'acetilazione dell'istone, alla demetilazione del DNA e all'attivazione del promotore GR dell'esone 16 [17]. La rilevanza di questi effetti nell'uomo è stata recentemente dimostrata da Oberlander et al. [1] nell'analisi dello stato di metilazione del promotore GR nei siti di legame NGFI-A nelle cellule mononucleate del sangue del cordone ombelicale di neonati esposti a umore materno depresso o ansioso del terzo trimestre. È stato riscontrato che la depressione materna era associata ad un aumento della metilazione del promotore di GR 3F nei campioni di sangue fetale e questi modelli di metilazione predicevano la reattività HPA nei neonati a 17 mesi di età [1]. L'analisi del tessuto ippocampale di vittime di suicidio con una storia di abuso infantile indica analogamente una minore espressione di GR e una maggiore metilazione del promotore di GR 18F associata a interruzioni dell'ambiente precoce e conferma i risultati degli studi sui roditori che il legame differenziale di NGFI-A è una conseguenza funzionale di questi effetti epigenetici [19]. Tuttavia, l'impatto delle interazioni madre-bambino perinatali non è limitato alla regolazione della GR, come illustrato da Roth et al. [19] esaminando gli effetti dell'abuso postnatale sulla metilazione del fattore neurotrofico (BDNF) derivato dal cervello della prole [1]. Nei ratti, è stato riscontrato un aumento della metilazione dell'esone IV del promotore del BDNF e la conseguente diminuzione dell'mRNA del BDNF nella corteccia prefrontale in associazione con l'esposizione a periodi di cure materne abusive (trascinamento, manipolazione rude, ecc.). Come nel caso degli effetti delle differenze individuali nell'assistenza materna, questi effetti sono emersi nell'infanzia e sono stati mantenuti nell'età adulta. Inoltre, questi effetti sulla metilazione dell'esone IV del BDNF sono perpetuati nella generazione F20, suggerendo un ruolo per i meccanismi epigenetici negli effetti transgenerazionali [XNUMX].
Sviluppo nel corso della vita: epigenetica ed esperienza della plasticità dipendente
La sezione precedente evidenzia gli effetti stabili delle prime esperienze di vita e come questi eventi vengono codificati a livello molecolare. Un altro approccio allo studio dell'epigenetica e dello sviluppo deriva dagli studi sulla plasticità sinaptica durante l'espressione del potenziamento a lungo termine (LTP) e il consolidamento della memoria. È stato dimostrato che alti livelli di cura materna ed esposizione all'arricchimento giovanile dell'ambiente (EE) migliorano la capacità di apprendimento e la memoria associata al miglioramento della LTP [21,22]. Inoltre, recenti evidenze suggeriscono che l'EE modula le vie di segnalazione NMDAr / p38 / LTP nell'ippocampo e migliora la formazione della memoria di paura contestuale attraverso le generazioni in modo tale che anche la progenie delle madri arricchite mostri una LTP potenziata anche quando cross-fostered alla nascita a madri non arricchite [23 ]. L'arricchimento ambientale è stato associato ad un aumento dell'acetilazione dell'istone nell'ippocampo e al miglioramento della memoria spaziale [24,25]. Il targeting farmacologico dell'epigenoma è stato utilizzato per dimostrare il ruolo dell'acetilazione dell'istone e della metilazione del DNA nel consolidamento della memoria a lungo termine [26]. È stato dimostrato che il trattamento con zebularine (un inibitore o DNA metiltransferasi) blocca la formazione di memoria e riduce l'acetilazione degli istoni in seguito a condizionamento condizionale della paura nei ratti adulti [27] mentre il trattamento con l'inibitore HDAC butirrato di sodio porta a una maggiore formazione di memorie di paura contestuale [ 28]. L'obiettivo specifico di questi inibitori HDAC2 può essere HDAC2 come sono emerse recenti evidenze che illustrano la diminuzione della plasticità sinaptica e la formazione di memoria nei topi che sovra-esprimono HDAC1 ma non HDAC2; con l'effetto opposto nei topi con deficienza di HDAC29 [XNUMX]. Questi studi illustrano una possibile relazione tra attività sinaptica e acetilazione dell'istone / metilazione del DNA nei neuroni maturi, suggerendo che c'è continuità plasmatica in questi sistemi epigenetici oltre i periodi di sviluppo prenatale e postnatale.
Meccanismo epigenetico e regolazione della trasmissione sinaptica
I cambiamenti dipendenti dall'attività nell'espressione genica all'interno dei percorsi neuronali durante lo sviluppo possono servire come percorso critico che collega l'esperienza dell'ambiente esterno e le modificazioni epigenetiche all'interno del nucleo della cellula. In un recente studio, Monteggia e colleghi hanno elegantemente dimostrato che la trasmissione sinaptica spontanea nei neuroni ippocampali è regolata da alterazioni nella metilazione del DNA che si verificano in risposta all'attività sinaptica [30]. Il trattamento con un inibitore DNMT ha portato ad una riduzione significativa della frequenza delle correnti post-sinaptiche eccitatorie miniaturizzate (mEPSCs) e del tasso di fusione della vescicola sinaptica spontanea correlata con una diminuzione della metilazione del promotore I del BDNF e una maggiore espressione di BDNF. Questo effetto è stato bloccato con l'inibizione dell'attività sinaptica e le riduzioni di mEPSC sono state prevenute in assenza di MeCP2. Questi risultati suggeriscono fortemente un ruolo per la metilazione del DNA / vie MeCP2 nel controllo della funzione sinaptica. La fosforilazione dipendente dall'attività di MeCP2 tramite Ca2 + -calmodulindependent chinase II ha dimostrato di causare la dissociazione MeCP2 dai geni target e di alleviare la repressione trascrizionale [31]. Di conseguenza, i geni come BDNF sono aumentati nell'espressione che porta al normale pattern dendritico e allo sviluppo della colonna dendritica [32]. Questi risultati suggeriscono un meccanismo epigenetico attraverso il quale i neuroni possono monitorare le alterazioni nel livello di attività e regolare l'uscita del neurotrasmettitore attraverso l'espressione genica alterata con conseguenze per l'eccitabilità della rete e il raffinamento del circuito. Le alterazioni in questi percorsi MeCP2 possono portare a diverse anomalie dello sviluppo neurologico tra cui la sindrome di Rett, l'autismo infantile, il ritardo mentale e la schizofrenia [33] e la delezione mirata di MeCP2 nell'amigdala ha recentemente dimostrato di alterare l'apprendimento e la memoria e portare ad un aumento dell'ansia comportamento nei topi [34].
Controllo epigenetico della plasticità del periodo critico
Sebbene i meccanismi epigenetici siano stati certamente implicati nel mediare gli alti livelli di plasticità nello sviluppo iniziale, è anche possibile vedere la diminuita plasticità e sensibilità che si verifica più tardi nello sviluppo da una prospettiva epigenetica. I circuiti neocorticali sono estremamente sensibili alle manipolazioni dell'ambiente sensoriale durante finestre temporali ristrette di sviluppo postnatale chiamate "periodi critici". Ad esempio, uno squilibrio nella visione binoculare durante l'infanzia influisce sulla percezione che porta all'ambliopia o all '"occhio pigro". La deprivazione monoculare (MD) riproduce questo paradigma classico di plasticità dipendente dall'esperienza [35]. Il sorprendente effetto fisiologico della MD è un cambiamento nella risposta dei neuroni corticali visivi a favore dell'occhio non privato; un esempio di plasticità di dominanza oculare (OD). Il periodo critico durante il quale si verifica questa plasticità OD è definito dall'attivazione e successiva inibizione di percorsi molecolari specifici che coinvolgono molecole di segnalazione come aCaMKII, calcineurina, PKA, ERK e CREB [36]. Recentemente, Pizzorusso e colleghi hanno identificato rapidi aumenti della fosforilazione degli istoni dipendente da ERK associati all'attivazione della corteccia visiva giovanile e una sottoregolazione dello sviluppo di questo effetto nei topi più anziani [37]. Nei topi adulti, la ridotta plasticità OD può essere ripristinata attraverso il trattamento con l'inibitore HDAC tricostatina A (TSA). Meccanismi cellulari multipli potrebbero contribuire all'espressione della plasticità dipendente dall'esperienza [38]. È necessario un ulteriore lavoro per capire se i meccanismi epigenetici agiscono generalmente in tutti i substrati cellulari o solo all'interno di un sottoinsieme specifico.
La maturazione della mielina è stata anche proposta come uno dei principali fattori che contribuiscono alla diminuzione della plasticità neuronale. Durante l'inizio della plasticità del periodo critico, gli oligodendrociti iniziano a esprimere specifiche proteine strutturali della mielina, tra cui la proteina basica della mielina (MBP), la glicoproteina associata alla mielina (MAG), la glicoproteina oligodendrocita della mielina (OMgp) e la proteina basica dell'oligodendrocita associato alla mielina (MOBP) [ 39]. Quando la mielinizzazione raggiunge i livelli degli adulti, la plasticità OD è fortemente ridotta o assente. MAG e OMgp possono contribuire alla chiusura del periodo critico attraverso l'attivazione dei recettori Nogo. Infatti, i topi privi di recettori Nogo mostrano plasticità OD anche in età adulta [40]. Anche la manipolazione dello stato epigenetico degli oligodendrociti può essere una strategia efficace per modulare la plasticità. Casaccia-Bonnefil e colleghi hanno dimostrato che le modificazioni istoniche sono coinvolte nella differenziazione delle cellule precursori degli oligodendrociti (OPC) durante lo sviluppo e nel recupero dalla lesione [41]. È stato riscontrato che la somministrazione di acido valproico, un inibitore dell'HDAC, durante il periodo critico di insorgenza della mielinizzazione, impedisce la maturazione dell'OPC nelle cellule mieliniche. Questi risultati suggeriscono che l'attività HDAC durante una specifica finestra temporale di sviluppo postnatale è necessaria per la differenziazione e la mielinizzazione OPC. Nelle fasi successive dello sviluppo, la deacetilazione dell'istone si attenua e viene sostituita dalla metilazione repressiva dell'istone e dall'istituzione di una struttura cromatinica compatta, caratteristica del fenotipo oligodendrocitario differenziato [43]. Shen et al. [43] hanno scoperto che in risposta al danno degli oligodendrociti, si è verificata una robusta rimielinizzazione negli animali giovani ma non negli animali più anziani con la nuova sintesi della mielina preceduta dalla down-regolazione degli inibitori della differenziazione degli oligodendrociti e dei marcatori delle cellule staminali neurali e dal reclutamento di HDAC nelle regioni promotrici. Questo reclutamento di HDAC è inefficiente nei cervelli più anziani, consentendo l'accumulo di inibitori trascrizionali e la prevenzione dell'espressione genica della mielina. Questo effetto dipendente dall'età può essere indotto nei topi giovani trattati con inibitori HDAC durante il periodo in cui si verificano danni agli oligodentrociti. Quindi, ci sono cambiamenti epigenetici che sono caratteristici dei periodi di plasticità dello sviluppo che potrebbero fornire un obiettivo per l'intervento terapeutico in caso di danno al SNC. L'uso di inibitori HDAC per aumentare la plasticità nel cervello può essere un approccio terapeutico promettente poiché vi sono prove convergenti da modelli di roditori che il trattamento con questi composti (44) può portare a cambiamenti drammatici nell'espressione genica e nel comportamento nella prole adulta ha ricevuto bassi livelli di assistenza materna [1] e (15) imita gli effetti dell'EE sull'inversione delle anomalie dello sviluppo neurologico [2]. Piuttosto che produrre un aumento generalizzato della trascrizione, questi composti portano all'attivazione di un sottoinsieme specifico di geni [24-45], suggerendo un possibile intervento mirato per ripristinare la plasticità nel cervello adulto.
Conclusioni
Esistono prove convergenti del ruolo delle modificazioni epigenetiche come l'acetilazione dell'istone e la metilazione del DNA sia nella stabilità che nella plasticità dei circuiti neuronali in via di sviluppo. Gli effetti persistenti sull'espressione genica che possono essere raggiunti attraverso questi meccanismi forniscono un percorso biologico attraverso il quale le esperienze ambientali possono essere incorporate, portando a cambiamenti a lungo termine nella neurobiologia e nel comportamento. Migliorare la plasticità nel cervello adulto è una prospettiva entusiasmante e ci sono certamente prove emergenti che suggeriscono il possibile uso di fattori epigenetici per indurre un cervello `` più giovane ''. La sfida degli studi futuri è stabilire i percorsi attraverso i quali è possibile ottenere modifiche trascrizionali specifiche del sito e gene-specifiche e comprendere meglio il percorso attraverso il quale le esperienze nel corso della vita inducono questa plasticità molecolare.
Michela Fagiolini 1, Catherine L Jensen 2 e Frances A Champagne 2
Current Opinion in Neurobiology 2009, 19: 1 6
Questa recensione proviene da un problema a tema sullo sviluppo
A cura di Takao Hensch e Andrea Brand
0959-4388 / $ vedi frontespizio Pubblicato da Elsevier Ltd.
DOI 10.1016 / j.conb.2009.05.009
Autore corrispondente: Champagne, Frances A (fac2105@columbia.edu)
[fisarmonica title = "References"]
[titolo fisarmonica = "Riferimenti:" load = "hide"] 1. Mattick JS, Amaral PP, Dinger ME, Mercer TR, Mehler MF: RNA
regolazione dei processi epigenetici. Bioessays 2009, 31: 51-59.
2. Feng J, Fouse S, Fan G: regolazione epigenetica del gene neurale
espressione e funzione neuronale. Pediatr Res 2007, 61: 58R63R.
3. Razina A: metilazione della CpG, struttura della cromatina e gene
silenziamento: una connessione a tre vie. EMBO J 1998, 17: 4905-4908.
4. Fukuda S, Taga T: determinazione del destino cellulare regolata da a
rete di segnali trascrizionali nel cervello del topo in via di sviluppo.
Anat Sci Int 2005, 80: 12-18.
5. Fan G, Hutnick L: Metil-CpG proteine leganti nel nervoso
sistema. Cell Res 2005, 15: 255-261.
6. Strathdee G, Brown R: metilazione del DNA aberrante nel cancro:
potenziali interventi clinici. Esperto Rev Mol Med 2002,
2002: 1-17.
7. Mueller BR, Bale TL: programmazione specifica del sesso della prole
emotività dopo lo stress all'inizio della gravidanza. J Neurosci 2008,
28: 9055-9065.
Studio sui roditori che illustra le alterazioni nella metilazione del DNA di placenta e
tessuto cerebrale in seguito all'esposizione a stress gestazionale, fornendo un possibile
meccanismo di mediazione degli effetti neurobiologici a lungo termine di prenatale
esposizione ad elevata attività di HPA materna
8. Hoet JJ, Hanson MA: nutrizione intrauterina: la sua importanza
durante i periodi critici per cardiovascolare ed endocrino
sviluppo. J Physiol 1999, 514 (Pt 3): 617-627.
9. Zeisel SH: Importanza dei donatori di metile durante la riproduzione.
Am J Clin Nutr 2009, 89: 673S-677S.
10. Lillycrop KA, Phillips ES, Torrens C, Hanson MA, Jackson AA,
Burdge GC: Nutrire ratti gravide con una dieta a ridotto apporto proteico
altera persistentemente la metilazione di citosine specifiche nel
promotore alfa epatico PPAR della progenie. Br J Nutr 2008,
100: 278-282.
11. Lillycrop KA, Slater-Jefferies JL, Hanson MA, Godfrey KM,
Jackson AA, Burdge GC: induzione di epigenetica alterata
regolazione del recettore glucocorticoide epatico nel
progenie di ratti nutriti con una dieta a dieta limitata durante la gravidanza
suggerisce che è ridotta l'espressione di methyltransferase-1 del DNA
coinvolto nella compromissione della metilazione del DNA e dei cambiamenti nell'istone
modifiche. Br J Nutr 2007, 97: 1064-1073.
Illustra l'impatto dei donatori di metile nella dieta materna sulla prole
Metilazione del DNA e modelli di acetilazione dell'istone, che forniscono un importante
collegamento tra nutrizione e regolazione genica
12. Kovacheva VP, Mellott TJ, Davison JM, Wagner N, LopezCoviella
I, Schnitzler AC, Blusztajn JK: colina gestazionale
la mancanza causa il gene-gene globale e Igf2
ipermetilazione mediante sovraregolazione dell'espressione di Dnmt1. J Biol
Chem 2007, 282: 31777-31788.
13. Meaney MJ: cure materne, espressione genica e il
trasmissione di differenze individuali nella reattività allo stress
attraverso le generazioni. Annu Rev Neurosci 2001, 24: 1161-1192.
14. Champagne FA, tessitore IC, Diorio J, Dymov S, Szyf M,
Meaney MJ: assistenza materna associata alla metilazione del
promotore dell'estrogeno recettore-alfa1b ed estrogeno recettore
espressione nella zona preottica mediale della femmina
prole. Endocrinologia 2006, 147: 2909-2915.
15. Weaver IC, Cervoni N, Champagne FA, D Alessio AC, Sharma S,
Seckl JR, Dymov S, Szyf M, Meaney MJ: programmazione epigenetica
dal comportamento materno. Nat Neurosci 2004, 7: 847-854.
16. Weaver IC, D Alessio AC, Brown SE, Hellstrom IC, Dymov S,
Sharma S, Szyf M, Meaney MJ: Il fattore di trascrizione nervo
proteina inducibile dal fattore di crescita a media epigenetica
programmazione: modifica dei segni epigenetici con immediato immediato
geni. J Neurosci 2007, 27: 1756-1768.
17. Oberlander TF, Weinberg J, Papsdorf M, Grunau R, Misri S,
Devlin AM: esposizione prenatale alla depressione materna,
metilazione neonatale del gene del recettore glucocorticoide umano
(NR3C1) e le risposte allo stress del cortisolo infantile. L'epigenetica
2008, 3: 97-106.
Fornisce prove per la rilevanza dei meccanismi epigenetici nella mediazione
gli effetti dell'umore materno sullo sviluppo infantile. Illustra il
traduzione di approcci sperimentali condotti in modelli animali a
lo studio di questioni clinicamente rilevanti nell'uomo
18. McGowan PO, Sasaki A, D'Alessio AC, Dymov S, Labonte B,
Szyf M, Turecki G, Meaney MJ: Regolazione epigenetica del
recettore glucocorticoide nel cervello umano si associa con
abuso infantile. Nat Neurosci 2009, 12: 342-348.
Fornisce prove convincenti per la presenza di metilazione differenziale
di GR con conseguenze per l'espressione genica nell'ippocampo umano
in funzione dell'abuso della prima infanzia utilizzando il tessuto cerebrale ottenuto
dalle vittime del suicidio
19. Roth TL, Lubin FD, Funk AJ, Sweatt JD: epigenetico duraturo
influenza delle avversità della prima infanzia sul gene BDNF. Biol
Psichiatria 2009, 65: 760-769.
Studio dei roditori sull'impatto transgenerazionale dell'esposizione alla madre
abuso nell'infanzia e ruolo della metilazione differenziale del BDNF nel
corteccia prefrontale nel mediare questi effetti
20. Champagne FA: meccanismi epigenetici e il
effetti transgenerazionali della cura materna. Davanti
Neuroendocrinol 2008, 29: 386-397.
21. Bruel-Jungerman E, Laroche S, Rampon C: Nuovi neuroni nel
il giro dentato è coinvolto nell'espressione di potenziamento
memoria a lungo termine a seguito di arricchimento ambientale.
Eur J Neurosci 2005, 21: 513-521.
22. Champagne DL, Bagot RC, van Hasselt F, Ramakers G,
Meaney MJ, de Kloet ER, Joels M, Krugers H: assistenza materna e
plasticità dell'ippocampo: prove per esperienza-dipendente
plasticità strutturale, funzionamento sinaptico alterato e
reattività differenziale ai glucocorticoidi e allo stress.
J Neurosci 2008, 28: 6037-6045.
23. Arai JA, Li S, Hartley DM, Feig LA: Salvataggio transgenerazionale di a
difetto genetico nel potenziamento e memoria a lungo termine
formazione per arricchimento giovanile. J Neurosci 2009, 29: 1496-
1502
Studio sui roditori che illustra l'impatto transgenerazionale dell'ambiente
arricchimento su LTP suggerendo che i deficit geneticamente indotti possono essere
superare le condizioni ambientali sperimentate da una precedente
ELETTRICA
24. Fischer A, Sananbenesi F, Wang X, Dobbin M, Tsai LH: Recupero
di apprendimento e memoria è associata alla cromatina
rimodellamento. Natura 2007, 447: 178-182.
Studio sui roditori che dimostra che l'arricchimento ambientale aumenta l'istone
acetilazione nell'ippocampo. Gli inibitori dell'HDAC inducono maggiore spazio
memoria in un modello murino di disturbo neurodegenerativo
25. Williams BM, Luo Y, Ward C, Redd K, Gibson R, Kuczaj SA,
McCoy JG: arricchimento ambientale: effetti su spazio
immunoreattività CREB di memoria e ippocampo. Physiol
Behav 2001, 73: 649-658.
26. Sweatt JD: modifiche epigenetiche dipendenti dall'esperienza in
il sistema nervoso centrale. Biol Psychiatry 2009, 65: 191-197.
27. Lubin FD, Roth TL, Sweatt JD: Regolazione epigenetica del BDNF
trascrizione genica nel consolidamento della memoria della paura.
J Neurosci 2008, 28: 10576-10586.
Articolo recente di una serie di indagini del laboratorio Sweatt che illustrano
i cambiamenti dinamici alla metilazione del DNA che si verificano durante il processo
di apprendimento e il ruolo critico di queste modifiche nel consolidamento
di memoria
28. Levenson JM, Roth TL, Lubin FD, Miller CA, Huang IC, Desai P,
Malone LM, Sweatt JD: Evidenza che il DNA (citosina-5)
metiltransferasi regola la plasticità sinaptica nel
ippocampo. J Biol Chem 2006, 281: 15763-15773.
29. Guan JS, Haggarty SJ, Giacometti E, Dannenberg JH, Joseph N,
Gao J, Nieland TJ, Zhou Y, Wang X, Mazitschek R et al .: HDAC2
regola negativamente la formazione di memoria e sinaptica
plasticità. Natura 2009, 459: 55-60.
Studiare nei topi esaminando il particolare bersaglio dell'HDAC attraverso il quale l'HDAC
gli inibitori esercitano miglioramenti nella plasticità sinaptica e nella memoria. utilizzando
up-down regolato e mirato di HDAC2 gli autori illustrano il
importanza dei livelli di questo enzima nella mediazione del miglioramento cognitivo
30. Nelson ED, Kavalali ET, Monteggia LM: dipendente dalle attività
soppressione della neurotrasmissione in miniatura attraverso il
regolazione della metilazione del DNA. J Neurosci 2008, 28: 395-406.
Questo documento si concentra sulla regolazione della metilazione del DNA da parte di NMDA
attività sinaptica mediata dai recettori all'interno dei neuroni maturi e come
alterazioni epigenetiche influenzano la funzione sinaptica basale. Questi risultati
suggerire una base sinaptica per i sintomi neurologici associati a
disturbi del neurosviluppo come la sindrome di Rett
31. Chen WG, Chang Q, Lin Y, Meissner A, West AE, Griffith EC,
Jaenisch R, Greenberg ME: Derepression della trascrizione di BDNF
coinvolge fosforilazione calcio-dipendente di MeCP2.
Science 2003, 302: 885-889.
32. Zhou Z, Hong EJ, Cohen S, Zhao WN, Ho HY, Schmidt L,
Chen WG, Lin Y, Savner E, Griffith EC et al .: Brain-specific
la fosforilazione di MeCP2 regola Bdnf dipendente dall'attività
trascrizione, crescita dendritica e maturazione della colonna vertebrale. Neurone
2006, 52: 255-269.
33. Moretti P, Zoghbi HY: Disfunzione MeCP2 nella sindrome di Rett e
disturbi correlati. Curr Opin Genet Dev 2006, 16: 276-281.
34. Adachi M, Autry AE, Covington HE 3rd, Monteggia LM: MeCP2-
repressione della trascrizione mediata nell'amigdala basolaterale
può essere alla base di un'ansia intensa in un modello murino di Rett
sindrome. J Neurosci 2009, 29: 4218-4227.
35. Tropea D, Van Wart A, Sur M: Meccanismi molecolari di
plasticità esperienza-dipendente nella corteccia visiva. Philos Trans
R Soc Lond B Biol Sci 2009, 364: 341-355.
36. Medini P, Pizzorusso T: Esperienza visiva e plasticità del
corteccia visiva: un ruolo per i meccanismi epigenetici. Front Biosci
2008, 13: 3000-3007.
37. Putignano E, Lonetti G, Cancedda L, Ratto G, Costa M, Maffei L,
Pizzorusso T: Downregulation dello sviluppo dell'istone
le modifiche post-traduzionali regolano la corticale visiva
plasticità. Neuron 2007, 53: 747-759.
Gli autori identificano la regolazione dipendente da ERK / MAPK delle modifiche dell'istone
come un nuovo meccanismo alla base dell'espressione dell'oculare
plasticità dominante
38. Hensch TK: meccanismi del periodo critico nello sviluppo visivo
corteccia. Curr Top Dev Biol 2005, 69: 215-237.
39. Quarles RH: guaine mieliniche: glicoproteine coinvolte nella loro
formazione, manutenzione e degenerazione. Cell Mol Life Sci
2002, 59: 1851-1871.
40. McGee AW, Yang Y, Fischer QS, Daw NW, Strittmatter SM:
Plasticità visiva guidata dalla corteccia visiva limitata dalla mielina
e il recettore Nogo. Science 2005, 309: 2222-2226.
41. Lui Y, Dupree J, Wang J, Sandoval J, Li J, Liu H, Shi Y, Nave KA,
Casaccia-Bonnefil P: il fattore di trascrizione Yin Yang 1 è
essenziale per la differenziazione dei progenitori degli oligodendrociti.
Neuron 2007, 55: 217-230.
42. Shen S, Casaccia-Bonnefil P: modifiche post-traduzionali
di istoni nucleosomali nel lignaggio degli oligodendrociti
cellule nello sviluppo e nella malattia. J Mol Neurosci 2008,
35: 13-22.
43. Shen S, Li J, Casaccia-Bonnefil P: modifiche degli istoni
influenzare il timing della differenziazione dei progenitori oligodendrociti
nel cervello del ratto in via di sviluppo. J Cell Biol 2005, 169:
577-589.
44. Shen S, Sandoval J, Swiss VA, Li J, Dupree J, Franklin RJ,
Casaccia-Bonnefil P: controllo epigenetico dipendente dall'età di
inibitori di differenziazione è fondamentale per l'efficienza della rimielinizzazione.
Nat Neurosci 2008, 11: 1024-1034.
Questo documento fornisce una visione meccanicistica di come i precursori degli oligodendrociti
la differenziazione cellulare è regolata epigeneticamente durante la rimielinizzazione
e come questi meccanismi cambiano con l'invecchiamento.
45. Fass DM, Butler JE, Goodman RH: l'attività della deacetilasi è
richiesto per l'attivazione di cAMP di un sottoinsieme di target CREB
geni. J Biol Chem 2003, 278: 43014-43019.
46. Vecsey CG, Hawk JD, Lattal KM, Stein JM, Fabian SA, Attner MA,
Cabrera SM, McDonough CB, Brindle PK, Abel T et al .: Histone
gli inibitori della deacetilasi migliorano la memoria e la sinaptica
plasticità tramite CREB: attivazione trascrizionale CBP-dipendente.
J Neurosci 2007, 27: 6128-6140.
47. Weaver IC, Meaney MJ, Szyf M: Effetti materni sulla cura di
trascrittoma ippocampale e comportamenti mediati dall'ansia
nella progenie che sono reversibili in età adulta. Proc Natl Acad
Sci USA 2006, 103: 3480-3485.
[/fisarmonica]
[/ Fisarmoniche]