Gli ossidanti sono generalmente prodotti in modo controllato al fine di regolare i processi essenziali nel corpo umano, compresa la divisione cellulare, l'infiammazione, la funzione immunitaria, l'autofagia e la risposta allo stress. Tuttavia, la produzione incontrollata di questi ossidanti può contribuire a lo stress ossidativo, che può influire sulla funzione cellulare, portando allo sviluppo di tossicità, malattie croniche e cancro. I meccanismi antiossidanti protettivi del corpo umano sono regolati da una serie di percorsi vitali che controllano la risposta della cellula agli ossidanti. Il fattore nucleare fattore eritroide 2, altrimenti noto come Nrf2, è un regolatore emergente della resistenza cellulare agli ossidanti. Lo scopo di questo articolo è discutere e dimostrare il ruolo emergente di Nrf2 nella funzione mitocondriale.
Contenuti
Astratto
Il fattore di trascrizione NF-E2 fattore 45 correlato a p2 (Nrf2; nome del gene NFE2L2) consente l'adattamento e la sopravvivenza in condizioni di stress regolando l'espressione genica di diverse reti di proteine citoprotettive, inclusi enzimi antiossidanti, antinfiammatori e disintossicanti come proteine che aiutano nella riparazione o nella rimozione delle macromolecole danneggiate. Nrf2 ha un ruolo cruciale nel mantenimento dell'omeostasi redox cellulare regolando la biosintesi, l'utilizzo e la rigenerazione di glutatione, tioredossina e NADPH e controllando la produzione di specie reattive dell'ossigeno da parte dei mitocondri e della NADPH ossidasi. In condizioni omeostatiche, Nrf2 influenza il potenziale della membrana mitocondriale, l'ossidazione degli acidi grassi, la disponibilità di substrati (NADH e FADH2 / succinato) per la respirazione e la sintesi di ATP. In condizioni di stress o stimolazione del fattore di crescita, l'attivazione di Nrf2 contrasta l'aumento della produzione di specie reattive dell'ossigeno nei mitocondri attraverso la sovraregolazione trascrizionale della proteina di disaccoppiamento 3 e influenza la biogenesi mitocondriale mantenendo i livelli del fattore respiratorio nucleare 1 e del recettore attivato dal proliferatore del perossisoma? coattivatore 1, nonché promuovendo la biosintesi dei nucleotidi purinici. Gli attivatori Nrf2 farmacologici, come l'isotiocianato sulforafano presente in natura, inibiscono l'apertura mediata dall'ossidante del poro di transizione della permeabilità mitocondriale e il rigonfiamento mitocondriale. Curiosamente, è stato scoperto che un composto 1,4-difenil-1,2,3-triazolo sintetico, originariamente progettato come attivatore Nrf2, promuove la mitofagia, contribuendo così all'omeostasi mitocondriale complessiva. Pertanto, Nrf2 è un attore di primo piano nel supportare l'integrità strutturale e funzionale dei mitocondri e questo ruolo è particolarmente cruciale in condizioni di stress.
parole chiave: Bioenergetica, Cytoprotection, Keap1, Mitocondri, Nrf2, Radicali liberi
Highlight
- Nrf2 ha un ruolo cruciale nel mantenimento dell'omeostasi redox cellulare.
- Nrf2 agisce sul potenziale della membrana mitocondriale e sulla sintesi dell'ATP.
- Nrf2 influenza l'ossidazione degli acidi grassi mitocondriali.
- Nrf2 supporta l'integrità strutturale e funzionale dei mitocondri.
- Gli attivatori Nrf2 hanno effetti benefici quando la funzione mitocondriale è compromessa.
Introduzione
Il fattore di trascrizione NF-E2 fattore 45 correlato a p2 (Nrf2; nome del gene NFE2L2) regola l'espressione di reti di geni che codificano proteine con diverse attività citoprotettive. Nrf2 stesso è controllato principalmente a livello di stabilità proteica. In condizioni basali, Nrf2 è una proteina di breve durata soggetta a continua ubiquitinazione e degradazione proteasomica. Esistono tre sistemi noti di ubiquitina ligasi che contribuiscono alla degradazione di Nrf2. Storicamente, il primo regolatore negativo di Nrf2 scoperto è stata la proteina 1 associata a Kelch-like ECH (Keap1) [1], una proteina adattatore del substrato per Cullin 3 (Cul3) / Rbx1 ubiquitina ligasi [2], [3], [ 4]. Keap1 utilizza un meccanismo ciclico altamente efficiente per indirizzare Nrf2 per l'ubiquitinazione e la degradazione proteasomale, durante la quale Keap1 viene continuamente rigenerato, consentendo al ciclo di procedere (Fig. 1A) [5]. Nrf2 è anche soggetto a degradazione mediata dalla glicogeno sintasi chinasi (GSK) 3 /? - ubiquitina ligasi basata su Cul1 TrCP-dipendente [6], [7]. Più recentemente, è stato riportato che, in condizioni di stress del reticolo endoplasmatico, Nrf2 è ubiquitinato e degradato in un processo mediato dalla E3 ubiquitina ligasi Hrd1 [8].
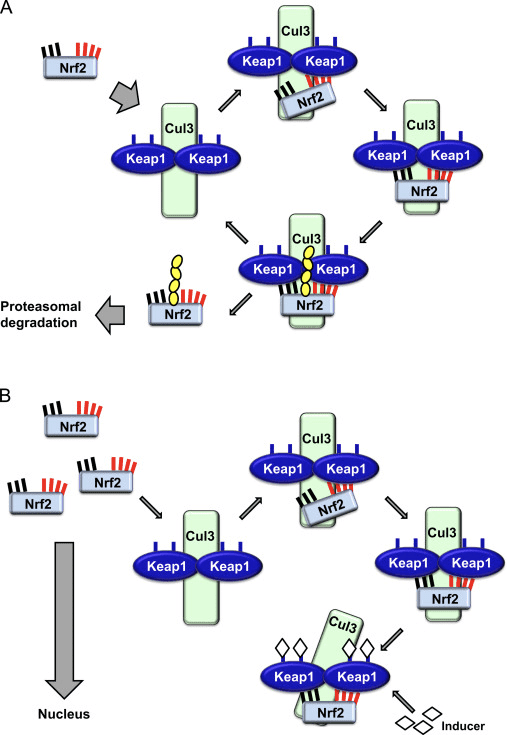
Oltre a servire come proteina dell'adattatore del substrato della ubiquitina ligasi, Keap1 è anche il sensore per un'ampia gamma di attivatori di piccole molecole di Nrf2 (denominati induttori) [9]. Gli induttori bloccano il ciclo di degradazione mediata da Keap1 di Nrf2 modificando chimicamente residui di cisteina specifici all'interno di Keap1 [10], [11] o interrompendo direttamente l'interfaccia di associazione KfXXUMX: Nrf1 [2], [12]. Di conseguenza, Nrf13 non viene degradato e il fattore di trascrizione si accumula e si traslocano nel nucleo (Figura 2B), dove forma un eterodimero con una piccola proteina Maf; si lega agli elementi di risposta antiossidante, le regioni regolatorie a monte dei suoi geni bersaglio; e avvia la trascrizione [1], [14], [15]. La batteria di bersagli Nrf16 comprende proteine con diverse funzioni citoprotettive, compresi enzimi del metabolismo xenobiotico, proteine con funzioni antiossidanti e antinfiammatorie e subunità proteasomali, così come proteine che regolano l'omeostasi redox cellulare e partecipano al metabolismo intermedio.
Nrf2: un Master Regulator of Cellular Redox Homeostasis
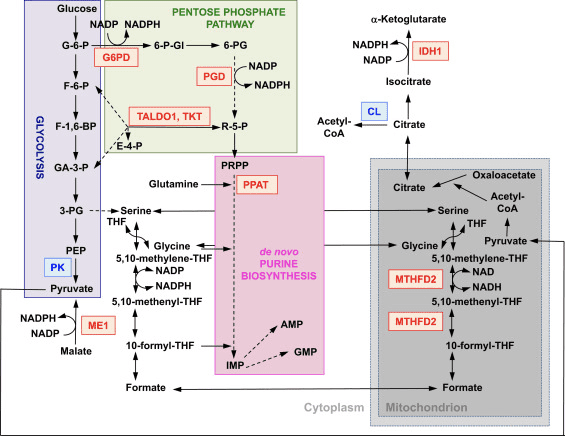
La funzione di Nrf2 come regolatore principale dell'omeostasi redox cellulare è ampiamente riconosciuta. L'espressione genica sia della subunità catalitica che di quella regolatrice della? -Glutamil cisteina ligasi, l'enzima che catalizza la fase di limitazione della velocità nella biosintesi del glutatione ridotto (GSH), è regolata direttamente da Nrf2 [17]. La subunità xCT del sistema xc-, che importa la cistina nelle cellule, è anche un bersaglio trascrizionale diretto di Nrf2 [18]. Nella cellula, la cistina subisce la conversione in cisteina, un precursore della biosintesi del GSH. Oltre al suo ruolo nella biosintesi del GSH, Nrf2 fornisce i mezzi per il mantenimento del glutatione nel suo stato ridotto mediante la regolazione trascrizionale coordinata della glutatione reduttasi 1 [19], [20], che riduce il glutatione ossidato a GSH utilizzando equivalenti riducenti da NADPH . Il NADPH richiesto è fornito da quattro principali enzimi che generano NADPH, enzima malico 1 (ME1), isocitrato deidrogenasi 1 (IDH1), glucosio-6-fosfato deidrogenasi (G6PD) e 6-fosfogluconato deidrogenasi (PGD), che sono trascrizionalmente regolato in parte da Nrf2 (Fig. 2) [21], [22], [23], [24]. Curiosamente, Nrf2 regola anche l'espressione genica inducibile delle forme citosolica, microsomiale e mitocondriale dell'aldeide deidrogenasi [25], che utilizzano NAD (P) + come cofattore, dando origine a NAD (P) H. In effetti, i livelli di NADPH e il rapporto NADPH / NADP + sono inferiori nei fibroblasti embrionali isolati da topi Nrf2-knockout (Nrf2-KO) rispetto alle cellule delle loro controparti wild-type (WT), e i livelli di NADPH diminuiscono con l'abbattimento di Nrf2 in linee cellulari cancerose con Nrf2 costitutivamente attivo [26]. Come previsto, i livelli di GSH sono inferiori nelle cellule in cui Nrf2 è stato interrotto; al contrario, l'attivazione di Nrf2 per via genetica o farmacologica porta alla sovraregolazione del GSH [27], [28], [29]. È importante sottolineare che Nrf2 regola anche l'espressione genica della tioredossina [30], [31], [32], tioredossina reduttasi 1 [28], [29], [32], [33] e sulfiredossina [34], che sono essenziali per la riduzione dei tioli proteici ossidati.
Dato il ruolo cruciale di Nrf2 come regolatore principale dell'omeostasi redox cellulare, non è sorprendente che, rispetto alle cellule WT, i livelli di specie reattive dell'ossigeno (ROS) siano più alti nelle cellule in cui Nrf2 è stato interrotto (Nrf2-KO) [35]. Questa differenza è particolarmente evidente in caso di sfida con agenti che causano stress ossidativo. Inoltre, le cellule carenti di Nrf2 sono molto più sensibili alla tossicità degli ossidanti di vario tipo e non possono essere protette dagli induttori Nrf2 che, nelle stesse condizioni, forniscono una protezione efficiente e duratura alle cellule WT [29], [36] , [37]. Oltre all'omeostasi della redox cellulare, Nrf2 è anche fondamentale per il mantenimento dell'omeostasi redox mitocondriale. Pertanto, rispetto al WT, il pool totale di NADH mitocondriale è significativamente aumentato in Keap1-KO e drasticamente diminuito nelle cellule Nrf2-KO [35].
Utilizzando l'imaging di cellule vive, abbiamo recentemente monitorato i tassi di produzione di ROS in coclee glioneuronali primarie e fette di tessuto cerebrale isolate da topi WT, Nrf2-KO o Keap1-knockdown (Keap1-KD) [38]. Come previsto, il tasso di produzione di ROS era più veloce nelle cellule e nei tessuti Nrf2-KO rispetto alle controparti WT. Tuttavia, abbiamo fatto l'osservazione inaspettata che, rispetto al WT, le cellule Keap1-KD hanno anche tassi più alti di produzione di ROS, sebbene l'entità della differenza tra i genotipi di WT e Keap1-KD fosse inferiore a quella tra WT e Nrf2-KO . Abbiamo quindi analizzato i livelli di mRNA di NOX2 e NOX4, le subunità catalitiche delle due isoforme di NADPH ossidasi (NOX) che sono state implicate nella patologia cerebrale e hanno scoperto che NOX2 è drasticamente aumentato in condizioni di deficit di Nrf2, mentre NOX4 è sovraregolato quando Nrf2 è costitutivamente attivato, anche se in misura minore. Quantitativamente, l'entità della sovraregolazione nelle cellule e nei tessuti dai topi mutanti è parallela ai corrispondenti aumenti della produzione di ROS [38]. È interessante notare che Nrf2 non solo regola la NADPH ossidasi, ma il ROS prodotto dalla NADPH ossidasi può attivare Nrf2, come mostrato nelle cellule epiteliali polmonari e nei cardiomiociti [39], [40]. Inoltre, uno studio molto recente ha dimostrato che l'attivazione NADPH ossidasi-dipendente di Nrf2 costituisce un importante meccanismo endogeno per la protezione contro il danno mitocondriale e la morte cellulare nel cuore durante il sovraccarico di pressione cronica [41].
Oltre all'attività catalitica della NADPH ossidasi, la respirazione mitocondriale è un'altra importante fonte intracellulare di ROS. Con l'uso della sonda MitoSOX specifica dei mitocondri, abbiamo esaminato il contributo dei ROS dell'origine mitocondriale alla produzione complessiva di ROS in colture primarie glioneuronali isolate da topi WT, Nrf2-KO o Keap1-KD [38]. Come previsto, le cellule Nrf2-KO presentavano tassi più elevati di produzione di ROS mitocondriale rispetto al WT. In accordo con i risultati della produzione complessiva di ROS, i tassi di produzione di ROS dei mitocondri in Keap1-KD erano anche più alti rispetto alle cellule WT. È importante sottolineare che il blocco del complesso I con rotenone ha causato un notevole aumento della produzione di ROS mitocondriale in entrambe le cellule WT e Keap1-KD, ma non ha avuto alcun effetto sulle cellule Nrf2-KO. In contrasto con l'aumento previsto della produzione di ROS mitocondriale nelle cellule WT dopo l'aggiunta di piruvato (per aumentare la disponibilità di NADH, aumentare il potenziale di membrana mitocondriale e normalizzare la respirazione), la produzione di ROS è diminuita nelle cellule Nrf2-KO. Insieme, questi risultati suggeriscono fortemente che, in assenza di Nrf2: (i) l'attività del complesso I è compromessa, (ii) l'attività compromessa del complesso I è dovuta alla limitazione dei substrati e (iii) l'attività compromessa del complesso I è una delle ragioni principali per l'aumento della produzione di ROS mitocondriale, probabilmente a causa del flusso di elettroni inversi dal complesso II.
Nrf2 Influisce sul potenziale e sulla respirazione della membrana mitocondriale
Il potenziale di membrana mitocondriale (?? m) è un indicatore universale della salute mitocondriale e dello stato metabolico della cellula. In una cellula sana, ?? m è mantenuto dalla catena respiratoria mitocondriale. È interessante notare che un'etichettatura isotopica stabile con aminoacidi in uno studio di proteomica basato su colture nella linea cellulare MCF10A epiteliale mammaria non tumorale negativa al recettore degli estrogeni ha dimostrato che il componente della catena di trasporto degli elettroni mitocondriale NDUFA4 è sovraregolato dall'attivazione farmacologica (da sulforafano) di Nrf2, mentre la sovraregolazione genetica di Nrf2 (da Keap1 knockdown) porta alla sottoregolazione delle subunità della citocromo c ossidasi COX2 e COX4I1 [42]. Uno studio del proteoma epatico utilizzando l'elettroforesi su gel bidimensionale e la spettrometria di massa di desorbimento / ionizzazione laser assistita da matrice ha scoperto che Nrf2 regola l'espressione della subunità ATP sintasi? [43]. Inoltre, è stato riportato che la proteina mitocondriale DJ-1, che svolge un ruolo nel mantenimento dell'attività del complesso I [44], stabilizza Nrf2 [45], [46], sebbene gli effetti neuroprotettivi dell'attivazione farmacologica o genetica di Nrf2 sono indipendenti da DJ-1 [47]. Tuttavia, le conseguenze di queste osservazioni per la funzione mitocondriale non sono state studiate.
In accordo con l'attività ridotta del complesso I in condizioni di deficit di Nrf2, il basale ?? m è inferiore nei fibroblasti embrionali di topo Nrf2-KO (MEF) e nelle cellule glioneuronali primarie coltivate rispetto alle loro controparti WT (Fig.3, riquadro) [35]. Al contrario, il basale ?? m è più alto quando Nrf2 è geneticamente costitutivamente sovraregolato (per knockdown o knockout di Keap1). Queste differenze di m tra i genotipi indicano che la respirazione è influenzata dall'attività di Nrf2. Infatti, la valutazione del consumo di ossigeno allo stato basale ha rivelato che, rispetto al WT, il consumo di ossigeno è inferiore nei MEF Nrf2-KO e Keap1-KO, rispettivamente di ~ 50 e ~ 35%.
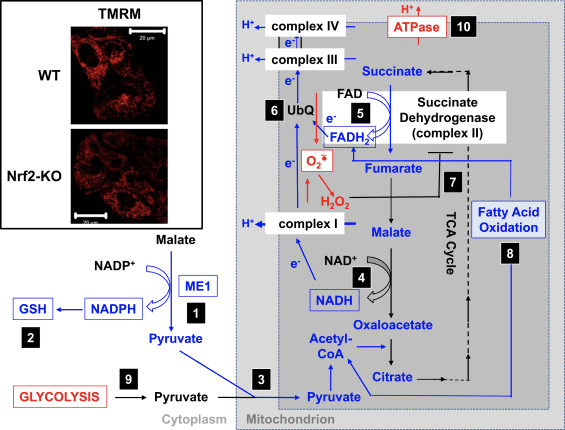
Queste differenze di m e respirazione tra i genotipi si riflettono nella velocità di utilizzo dei substrati per la respirazione mitocondriale. L'applicazione di substrati per il ciclo dell'acido tricarbossilico (TCA) (malato / piruvato, che a sua volta aumenta la produzione del substrato del complesso I NADH) o del metil succinato, un substrato per il complesso II, provoca un aumento graduale di ?? m in entrambi i pesi e neuroni Keap1-KD, ma il tasso di aumento è maggiore nelle cellule Keap1-KD. Ancora più importante, le forme della risposta a questi substrati del ciclo TCA sono diverse tra i due genotipi, per cui il rapido aumento di ?? m nelle cellule Keap1-KD dopo l'aggiunta del substrato è seguito da un rapido calo piuttosto che da un plateau, suggerendo un insolitamente rapido consumo di substrato. Questi risultati sono in stretto accordo con i livelli molto più bassi (del 50-70%) di malato, piruvato e succinato che sono stati osservati dopo un impulso di 1 ora di glucosio [U-13C6] in Keap1-KO rispetto a WT MEF cellule [24]. Nei neuroni Nrf2-KO, solo il piruvato è in grado di aumentare il ?? m, mentre il malato e il metil succinato causano una lieve depolarizzazione. L'effetto di Nrf2 sulla produzione di substrato mitocondriale sembra essere il meccanismo principale con cui Nrf2 influenza la funzione mitocondriale. L'indice di redox NADH mitocondriale (l'equilibrio tra il consumo di NADH da parte del complesso I e la produzione di NADPH nel ciclo TCA) è significativamente inferiore nelle cellule Nrf2-KO rispetto alle loro controparti WT, e inoltre, i tassi di rigenerazione dei pool di NADH e FADH2 dopo l'inibizione del complesso IV (mediante l'uso di NaCN) sono più lenti nelle cellule mutanti.
Nei mitocondri isolati dal cervello e dal fegato murini, l'integrazione di substrati per il complesso I o per il complesso II aumenta il tasso di consumo di ossigeno più fortemente quando Nrf2 è attivato e meno efficientemente quando Nrf2 viene interrotto [35]. Pertanto, il malato induce un tasso più elevato di consumo di ossigeno in Keap1-KD rispetto a WT, ma il suo effetto è più debole nei mitocondri Nrf2-KO. Allo stesso modo, in presenza di rotenone (quando il complesso I è inibito), il succinato attiva il consumo di ossigeno in misura maggiore in Keap1-KD rispetto a WT, mentre la risposta nei mitocondri Nrf2-KO è diminuita. Inoltre, le colture neuronali primarie Nrf2-KO e i topi sono più sensibili alla tossicità degli inibitori del complesso II acido 3-nitropropionico e malonato, mentre il trapianto intrastriatale di astrociti con sovraesprimono Nrf2 è protettivo [48], [49]. Allo stesso modo, i topi Nrf2-KO sono più sensibili, mentre l'attivazione genetica o farmacologica di Nrf2 ha effetti protettivi contro la neurotossicità causata dallo ione 1-metil-4-fenilpiridinio del complesso I inibitore nell'1-metil-4-fenil-1,2,3,6, 49-tetraidropiridina modello animale del morbo di Parkinson [50], [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [XNUMX].
Il rapporto di controllo respiratorio (RCR), il rapporto tra la respirazione di Stato 3 (stimolata da ADP) e di Stato 4 (nessun ADP presente), è diminuito in assenza di Nrf2, ma l'RCR è simile tra i mitocondri Keap1-KD e WT [35 ]. Poiché l'RCR è un'indicazione del grado di accoppiamento dell'attività della catena respiratoria mitocondriale alla fosforilazione ossidativa, questo risultato indica che il tasso più elevato di respirazione nei mitocondri Keap1-KD non è dovuto al disaccoppiamento della fosforilazione ossidativa. Suggerisce inoltre che la fosforilazione ossidativa è più efficiente quando Nrf2 è attivato. Il più alto tasso di respirazione nei mitocondri Keap1-KD è coerente con i livelli più alti di produzione di ROS mitocondriali [38] poiché tassi di respirazione più alti possono portare a una maggiore perdita di elettroni. Tuttavia, in condizioni di stress ossidativo, l'aumento della produzione di ROS è contrastato dalla sovraregolazione trascrizionale dipendente da Nrf2 della proteina di disaccoppiamento 3 (UCP3), che aumenta la conduttanza protonica della membrana interna mitocondriale e di conseguenza diminuisce la produzione di superossido [62]. Molto recentemente, è stato dimostrato che il prodotto di perossidazione lipidica 4-idrossi-2-nonenale media la sovraregolazione Nrf2-dipendente di UCP3 nei cardiomiociti; questo potrebbe essere particolarmente importante per la protezione in condizioni di stress ossidativo come quelle durante la riperfusione di ischemia [63].
Nrf2 influenza l'efficienza della fosforilazione ossidativa e la sintesi dell'ATP
In accordo con l'effetto di Nrf2 sulla respirazione, nei mitocondri del cervello e del fegato, la carenza di Nrf2 si traduce in una diminuzione dell'efficienza della fosforilazione ossidativa (come stimato dal rapporto tra ADP e ossigeno, che viene consumato per la sintesi di ATP), mentre l'attivazione di Nrf2 (Keap1 -KD) ha l'effetto opposto [35]. Rispetto al WT, i livelli di ATP sono significativamente più alti nelle cellule con sovraregolazione costitutiva di Nrf2 e inferiori quando Nrf2 viene abbattuto [64] o interrotto [35]. Inoltre, l'uso di inibitori della fosforilazione ossidativa (oligomicina) o della glicolisi (acido iodoacetico) ha rivelato che Nrf2 cambia il modo in cui le cellule producono ATP. Pertanto, nei neuroni WT, l'oligomicina causa un calo completo dell'ATP e l'acido iodoacetico non ha ulteriori effetti. Sorprendentemente, nelle cellule Nrf2-KO, l'oligomicina aumenta i livelli di ATP, che vengono poi lentamente, ma completamente, impoveriti dall'acido iodoacetico, indicando che in assenza di Nrf2, la glicolisi e non la fosforilazione ossidativa è la principale fonte di produzione di ATP. È interessante notare che, nonostante la maggiore efficienza della fosforilazione ossidativa nelle cellule Keap1-KD, l'aggiunta di oligomicina provoca una diminuzione dell'80% circa dei livelli di ATP e l'acido iodoacetico provoca un'ulteriore diminuzione del 20% circa. Pertanto, la carenza di Nrf2 o la sua attivazione costitutiva riduce il contributo della fosforilazione ossidativa e aumenta il contributo della glicolisi alla sintesi dell'ATP. Questo effetto è particolarmente pronunciato quando Nrf2 è assente ed è coerente con la dipendenza del ?? m dalla presenza di glucosio nel mezzo [35] e l'aumento dei livelli di intermedi glicolitici (G-6-P, F-6-P , diidrossiacetone fosfato, piruvato e lattato) dopo il knockdown di Nrf2 [24].
L'aumento dei livelli di ATP dopo l'inibizione dell'F1F0-ATPasi da parte dell'oligomicina indica che in assenza di Nrf2, l'F1F0-ATPasi funziona come ATPasi e non ATP sintasi, cioè opera al contrario. Tale inversione di attività molto probabilmente riflette la necessità di pompare protoni attraverso la membrana mitocondriale interna nel tentativo di mantenere il ?? m, che è cruciale per l'integrità funzionale di questo organello. L'inversione della funzione della F1F0-ATPasi è evidenziata anche dalla depolarizzazione mitocondriale osservata dopo somministrazione di oligomicina alle cellule Nrf2-KO, che è in netto contrasto con l'iperpolarizzazione che si verifica nelle loro controparti carenti di WT o Keap1 [35]. Nel complesso, sembra che in condizioni di carenza di Nrf2 l'ATP sia prodotto principalmente nella glicolisi, e questo ATP viene poi utilizzato in parte dalla F1F0-ATPasi per mantenere ?? m.
Nrf2 migliora l'ossidazione degli acidi grassi mitocondriali
L'effetto del deficit di Nrf2 sul ?? m è particolarmente pronunciato quando le cellule vengono incubate in un mezzo senza glucosio, e il ?? m è inferiore del ~ 50% in Nrf2-KO rispetto alle cellule WT [35]. In condizioni di privazione del glucosio, l'ossidazione degli acidi grassi mitocondriali (FAO) è un importante fornitore di substrati per la respirazione e la fosforilazione ossidativa, suggerendo che Nrf2 può influenzare la FAO. In effetti, l'efficienza della FAO sia per l'acido palmitico saturo a catena lunga (C16: 0) che per l'acido esanoico a catena corta (C6: 0) è maggiore nei MEF Keap1-KO e nei mitocondri isolati del cuore e del fegato rispetto ai loro Controparti WT, mentre è inferiore nelle cellule Nrf2-KO e nei mitocondri [65]. Questi effetti sono anche molto rilevanti per l'uomo: infatti, negli studi di intervento sull'uomo con diete ricche di glucorafanina, il precursore del classico attivatore Nrf2 sulforafano, sono stati segnalati cambiamenti metabolici indicativi di una migliore integrazione della FAO con l'attività del ciclo TCA [ 66].
Durante la prima fase della FAO mitocondriale, l'idrogeno pro-R del? -Carbonio lascia come idruro che riduce il cofattore FAD a FADH2, che a sua volta trasferisce gli elettroni all'ubiquinone (UbQ) nella catena respiratoria, contribuendo in ultima analisi alla produzione di ATP . Mentre la stimolazione della FAO da parte della palmitoilcarnitina in assenza di glucosio causa il previsto aumento dei livelli di ATP nelle cellule WT e Keap1-KO, con l'aumento dell'ATP più veloce nelle cellule Keap1-KO, lo stesso trattamento non produce cambiamenti di ATP in Nrf2-KO MEF [65]. Questo esperimento dimostra che, in assenza di Nrf2, la FAO viene soppressa e, inoltre, implica la soppressione della FAO come una delle ragioni per i livelli inferiori di ATP in condizioni di carenza di Nrf2 [35], [64].
In particolare, le cellule T 293 umane in cui Nrf2 è stato silenziato hanno un'espressione inferiore di CPT1 e CPT2 [67], due isoforme di carnitina palmitoiltransferasi (CPT), l'enzima limitante della velocità nella FAO mitocondriale. In accordo, i livelli di mRNA di Cpt1 sono inferiori nei fegati di Nrf2-KO rispetto ai topi WT [68]. CPT catalizza il trasferimento del gruppo acilico di un acile-CoA grasso a catena lunga dal coenzima A alla l-carnitina e consente quindi l'importazione di acilcarnitina dal citoplasma nei mitocondri. Sebbene questo non sia stato ancora esaminato, è possibile che oltre agli effetti di trascrizione sull'espressione di CPT1, Nrf2 possa anche influenzare la funzione di questo enzima controllando i livelli del suo principale inibitore allosterico, il malonil-CoA. Questo perché, tramite un meccanismo che non è chiaro, Nrf2 regola negativamente l'espressione di stearoil CoA desaturasi (SCD) [69] e citrato liasi (CL) [69], [70]. Curiosamente, l'eliminazione diretta o l'inibizione della SCD porta ad un aumento della fosforilazione e attivazione della protein chinasi attivata da AMP (AMPK) [71], [72], [73], e si può ipotizzare che, in assenza di Nrf2, i livelli di SCD aumenterà, a sua volta diminuendo l'attività AMPK. Ciò potrebbe essere ulteriormente aggravato dai livelli proteici ridotti di AMPK che sono stati osservati nei fegati dei topi Nrf2-KO [68], una scoperta che è in stretto accordo con i livelli aumentati di AMPK, che sono stati riportati nei fegati di Keap1-KD topi [74]. Una conseguenza della diminuita attività di AMPK è il sollievo della sua fosforilazione inibitoria (a Ser79) di acetil-CoA carbossilasi (ACC) [75], che potrebbe essere ulteriormente sovraregistrata transcriptionally in assenza di Nrf2 perché è downregolata dall'attivazione di Nrf2 [70 ]. L'elevata attività dell'ACC, in combinazione con l'espressione CL sovraregolata che aumenterà la produzione di acetil-CoA, il substrato per ACC, potrebbe infine aumentare i livelli del prodotto ACC, malonil-CoA. Gli alti livelli di malonil-CoA inibiscono il CPT, riducendo così il trasporto di acidi grassi nei mitocondri. Infine, Nrf2 regola positivamente l'espressione di CD36 [76], una translocasi che importa gli acidi grassi attraverso le membrane plasmatiche e mitocondriali. Quindi, un meccanismo attraverso il quale Nrf2 può influenzare l'efficienza della FAO mitocondriale è regolando l'importazione di acidi grassi a catena lunga nei mitocondri.
Oltre alla regolazione trascrizionale diretta, Nrf2 può anche alterare l'efficienza della FAO mitocondriale con i suoi effetti sul metabolismo del redox cellulare. Questo può essere particolarmente rilevante quando l'attività di Nrf2 è bassa o assente, condizioni che spostano lo stato di ossidoriduzione cellulare verso lo stato ossidato. In effetti, diversi enzimi FAO sono stati identificati come sensibili ai cambiamenti redox. Uno di questi enzimi è l'acil-CoA deidrogenasi a catena molto lunga (VLCAD), che contribuisce più dell'80% all'attività di deidrogenazione del palmitoil-CoA nei tessuti umani [77]. È interessante notare che Hurd et al. [78] hanno dimostrato che VLCAD contiene residui di cisteina che modificano significativamente il loro stato redox dopo l'esposizione di mitocondri di ratto isolati a H2O2. Inoltre, la S-nitrosilazione del VLCAD epatico murino in Cys238 migliora l'efficienza catalitica dell'enzima [79] ed è probabile che l'ossidazione della stessa cisteina possa avere l'effetto opposto, riducendo in definitiva l'efficienza della FAO mitocondriale. È quindi possibile che, sebbene i livelli di espressione di VLCAD non siano significativamente differenti in WT, Nrf2-KO o MEF Keap1-KO [65], l'attività enzimatica di VLCAD potrebbe essere inferiore in assenza di Nrf2 a causa dei livelli più alti di ROS.
Sulla base di tutti questi risultati, si può proporre che (Fig. 3): in assenza di Nrf2, i livelli di NADPH sono inferiori a causa della ridotta espressione di ME1, IDH1, G6PD e PGD. I livelli di glutatione ridotto sono anche inferiori a causa della ridotta espressione di enzimi che partecipano alla sua biosintesi e rigenerazione e ai livelli inferiori di NADPH necessari per la conversione della forma ossidata in glutatione ridotta. La bassa espressione di ME1 diminuirà il pool di piruvato che entra nei mitocondri, con la glicolisi che diventa la principale fonte di piruvato. La generazione di NADH è più lenta, portando ad una ridotta attività del complesso I e ad una maggiore produzione di ROS mitocondriali. Anche la riduzione di FAD a FADH2 è più lenta, almeno in parte a causa di un'ossidazione degli acidi grassi meno efficiente, che compromette il flusso di elettroni da FADH2 a UbQ e nel complesso III. Poiché UbQH2 è un attivatore della succinato deidrogenasi [80], rallentarne la formazione può ridurre l'attività enzimatica della succinato deidrogenasi. I livelli aumentati di superossido e perossido di idrogeno possono inibire ulteriormente l'attività del complesso II [81]. La minore efficienza dell'ossidazione degli acidi grassi contribuisce alla ridotta disponibilità di substrato per la respirazione mitocondriale e alla produzione di ATP nella fosforilazione ossidativa. Come meccanismo compensatorio, la glicolisi è migliorata. L'ATP sintasi funziona al contrario, come ATPasi, nel tentativo di mantenere il ?? m.
Nrf2 e biogenesi mitocondriale
È stato riportato che, rispetto al WT, i fegati dei topi Nrf2-KO hanno un contenuto mitocondriale inferiore (come determinato dal rapporto tra DNA mitocondriale e nucleare); questo è ulteriormente diminuito da un digiuno di 24 ore sia nei topi WT che Nrf2-KO; al contrario, sebbene non sia diverso dal WT in normali condizioni di alimentazione, il contenuto mitocondriale nei topi con elevata attività Nrf2 non è influenzato dal digiuno [82]. È interessante notare che l'integrazione con l'attivatore Nrf2 (R) -? - acido lipoico [83], [84], [85] promuove la biogenesi mitocondriale negli adipociti 3T3-L1 [86]. Due classi di regolatori trascrizionali nucleari svolgono un ruolo critico nella biogenesi mitocondriale. La prima classe sono i fattori di trascrizione, come i fattori respiratori nucleari11 e 2, che controllano l'espressione dei geni che codificano le subunità dei cinque complessi respiratori, i componenti traslazionali mitocondriali e gli enzimi biosintetici dell'eme che sono localizzati nella matrice mitocondriale [88]. Piantadosi et al. [89] hanno dimostrato che la sovraregolazione trascrizionale dipendente da Nrf2 del fattore respiratorio nucleare 1 promuove la biogenesi mitocondriale e protegge dalla citotossicità dell'agente chemioterapico cardiotossico antraciclina doxorubicina. Al contrario, Zhang et al. [82] hanno riferito che l'attivazione genetica di Nrf2 non influenza l'espressione dell'mRNA basale del fattore respiratorio nucleare 1 nel fegato murino.
La seconda classe di regolatori trascrizionali nucleari con funzioni critiche nella biogenesi mitocondriale sono i coattivatori trascrizionali, come il recettore attivato dal proliferatore del perossisoma? coattivatori (PGC) 1? e 1 ?, che interagiscono con i fattori di trascrizione, il meccanismo basale trascrizionale e di splicing dell'RNA e gli enzimi che modificano gli istoni [88], [90], [91]. L'espressione della famiglia di coattivatori PGC1 è influenzata da numerosi segnali ambientali. Il trattamento dei fibroblasti umani con l'attivatore Nrf2 sulforafano provoca un aumento della massa mitocondriale e l'induzione di PGC1? e PGC1? [92], sebbene la potenziale dipendenza da Nrf2 non sia stata esaminata in questo studio. Tuttavia, i topi diabetici in cui Nrf2 è attivato dal knockdown ipomorfico del gene Keap1 (db / db: Keap1flox / ?: Nrf2 + / +) o interrotto (db / db: Keap1flox / ?: Nrf2? /?) Hanno PGC1 epatico inferiore? livelli di espressione rispetto agli animali di controllo (db / db: Keap1flox / +: Nrf2 + / +) [93]. Nessuna differenza nei livelli di mRNA per PGC1? si osservano nel fegato di topi non diabetici che sono WT o Nrf2-KO, mentre questi livelli sono inferiori negli animali con sovraespressione di Nrf2 (Keap1-KD e Keap1-KO specifico per il fegato) [82]. In particolare, un digiuno di 24 ore aumenta i livelli di PGC1? mRNA nel fegato di topi di tutti i genotipi, ma l'aumento è significativamente maggiore nei fegati di Nrf2-KO rispetto ai topi con sovraesprimono WT o Nrf2. Rispetto al WT, i topi Nrf2-KO che presentano un'infezione settica o un danno polmonare acuto a causa di infezione mostrano un'attenuata sovraregolazione trascrizionale del fattore respiratorio nucleare 1 e PGC1? [94], [95]. Insieme, queste osservazioni suggeriscono che il ruolo di Nrf2 nel mantenere i livelli sia del fattore respiratorio nucleare 1 che di PGC1? è complesso e diventa più prominente in condizioni di stress.
Oltre all'espressione di geni che codificano per proteine mitocondriali, la biogenesi mitocondriale richiede la sintesi di nucleotidi. L'attivazione genetica di Nrf2 migliora la biosintesi delle purine sovraregolando la via del pentoso fosfato e il metabolismo dei folati e della glutammina, in particolare nelle cellule in rapida proliferazione (Fig. 2) [24]. L'analisi del trascrittoma della drosofila mutante carente per la proteina chinasi mitocondriale serina / treonina chinasi putativa indotta da PTEN 1 (PINK1) ha dimostrato che la disfunzione mitocondriale porta alla sovraregolazione trascrizionale dei geni che influenzano il metabolismo dei nucleotidi [96], suggerendo che la biosintesi dei nucleotidi potenziata rappresenta un meccanismo di protezione contro le conseguenze neurotossiche della carenza di PINK1. Nrf2 regola l'espressione della fosforibosil pirofosfato amidotransferasi (PPAT), che catalizza l'ingresso nella via biosintetica dei nucleotidi purinici de novo e della metilenetetraidrofolato deidrogenasi 2 (MTHFD2) mitocondriale. Quest'ultimo è un enzima bifunzionale con attività deidrogenasi e cicloidrolasi che è fondamentale nel fornire sia glicina che formiato come fonti di unità a un carbonio per la biosintesi delle purine in cellule in rapida crescita [2]. È quindi probabile che l'attivazione di Nrf97 possa essere protettiva e potrebbe invertire la disfunzione mitocondriale nella carenza di PINK2. Infatti, l'attivazione farmacologica di Nrf1 da parte del sulforafano, o il triterpenoide RTA-2, ripristina e protegge le cellule carenti di PINK408 dalla tossicità della dopamina [1]. Sebbene i meccanismi sottostanti sembrino complessi, insieme, questi risultati indicano che l'attività Nrf98 può influenzare la biogenesi mitocondriale influenzando i livelli di espressione di fattori di trascrizione critici e coattivatori, nonché migliorando la biosintesi dei nucleotidi.
Nrf2 e integrità mitocondriale
Sebbene le prove dirette non siano sempre disponibili, vi sono forti indicazioni del fatto che Nrf2 è importante per l'integrità mitocondriale, in particolare in condizioni di stress ossidativo. I mitocondri isolati dal cervello e dal fegato di ratti a cui era stata somministrata una dose singola dell'attivatore Nrf2 sulforaphane sono resistenti all'apertura del poro di transizione della permeabilità mitocondriale (mPTP) causato dall'ossidante tert-butilidroperossido [99], [100]. L'mPTP, un complesso che consente alla membrana mitocondriale di diventare permeabile alle molecole con masse fino a 1500 Da, è stato recentemente identificato per essere formato da dimeri della F0F1-ATP sintasi [101]. La resistenza mediata dal sulforaphane all'apertura di mPTP è correlata all'aumento delle difese antiossidanti ei livelli di GSH mitocondriale, glutatione perossidasi 1, enzima malico 3 e tioredossina 2 sono tutti sovraregolati in frazioni mitocondriali isolate da animali trattati con sulforaphane [100].
Il danno alle proteine mitocondriali e il deterioramento della respirazione causati dal prodotto di perossidazione lipidica elettrofila 4-idrossi-2-nonenale sono attenuati nei mitocondri isolati dalla corteccia cerebrale dei topi trattati con sulforafano [102]. Nelle cellule epiteliali renali di ratto e nel rene, il sulforafano è protettivo contro la tossicità indotta da cisplatino e gentamicina e la perdita di µm [103], [104]. Durante il trattamento delle cellule muscolari lisce aortiche di ratto con sulforafano sono stati osservati anche protezione contro un pannello di ossidanti (superossido, perossido di idrogeno, perossinitrito) ed elettrofili (4-idrossi-2-nonenale e acroleina) e un aumento delle difese antiossidanti mitocondriali [105 ]. In un modello di danno renale acuto indotto da contrasto, è stato recentemente dimostrato che il precondizionamento ischemico degli arti ha effetti protettivi, inclusa l'inibizione dell'apertura dell'mPTP e il gonfiore mitocondriale, mediante l'attivazione di Nrf2 conseguente all'inibizione di GSK3? [106].
La mitofagia, il processo mediante il quale i mitocondri disfunzionali vengono selettivamente inghiottiti dagli autofagosomi e consegnati ai lisosomi per essere degradati e riciclati dalla cellula, è essenziale per l'omeostasi mitocondriale [107], [108]. Considerando che non è stata stabilita alcuna relazione causale tra Nrf2 e mitofagia, ci sono prove che il fattore di trascrizione può essere importante nel controllo della qualità mitocondriale giocando un ruolo nella mitofagia. Ciò potrebbe essere particolarmente evidente in condizioni di stress ossidativo. Pertanto, in un modello di sepsi, gli aumenti dei livelli della catena leggera 1-II del marker autofagosoma MAP3 (LC3-II) e della proteina di carico p62 a 24 ore dopo l'infezione sono soppressi in Nrf2-KO rispetto ai topi WT [109] . Recentemente è stato scoperto un induttore della mitofagia a piccole molecole (chiamato induttore della mitofagia mediato da p62, PMI); questo composto 1,4-difenil-1,2,3-triazolo è stato originariamente progettato come attivatore Nrf2 che interrompe l'interazione del fattore di trascrizione con Keap1 [110]. Simile alle cellule in cui Nrf2 è geneticamente sovraregolato (Keap1-KD o Keap1-KO), le cellule esposte a PMI hanno un riposo maggiore. È importante sottolineare che l'aumento della localizzazione mitocondriale LC3 che si osserva dopo il trattamento PMI delle cellule WT non si verifica nelle cellule Nrf2-KO, suggerendo il coinvolgimento di Nrf2.
Infine, l'analisi ultrastrutturale delle sezioni epatiche ha rivelato la presenza di mitocondri gonfiati con ridotta crista e membrane disgregate negli epatociti di Nrf2-KO, ma non in WT, topi che erano stati nutriti con una dieta ricca di grassi per le settimane 24; in particolare, questi fegati mostrano evidenti prove dello stress ossidativo e dell'infiammazione [68]. Si può concludere che Nrf2 ha un ruolo fondamentale nel mantenimento dell'integrità mitocondriale in condizioni di stress ossidativo e infiammatorio.
Sulforafano e suoi effetti su cancro, mortalità, invecchiamento, cervello e comportamento, malattie cardiache e altro
Gli isotiocianati sono alcuni dei composti vegetali più importanti che si possono ottenere nella dieta. In questo video faccio il caso più completo per loro che sia mai stato fatto. Soglia di attenzione breve? Passa al tuo argomento preferito facendo clic su uno dei seguenti punti temporali. Timeline completa di seguito.
Sezioni chiave:
- 00: 01: 14 - Cancro e mortalità
- 00: 19: 04 - Invecchiamento
- 00: 26: 30 - Cervello e comportamento
- 00: 38: 06 - Riassunto finale
- 00: 40: 27 - Dose
Timeline completa:
- 00: 00: 34 - Introduzione di sulforaphane, uno degli obiettivi principali del video.
- 00: 01: 14 - Consumo di verdure crocifere e riduzione della mortalità per tutte le cause.
- 00: 02: 12 - Rischio di cancro alla prostata.
- 00: 02: 23 - Rischio di cancro alla vescica.
- 00: 02: 34 - Carcinoma polmonare nei fumatori.
- 00: 02: 48 - Rischio di cancro al seno.
- 00: 03: 13 - Ipotetico: cosa succede se hai già un cancro? (Interventistica)
- 00: 03: 35 - Meccanismo plausibile che guida i dati associativi sul cancro e sulla mortalità.
- 00: 04: 38 - Sulforaphane e cancro.
- 00: 05: 32 - Prova animale che mostra un forte effetto dell'estratto di germogli di broccolo sullo sviluppo del tumore della vescica nei ratti.
- 00: 06: 06 - Effetto dell'integrazione diretta di sulforafano nei pazienti affetti da cancro alla prostata.
- 00: 07: 09 - Bioaccumulo di metaboliti di isotiocianato nel tessuto mammario effettivo.
- 00: 08: 32 - Inibizione delle cellule staminali del carcinoma mammario.
- 00: 08: 53 - Lezione di storia: le brassiche sono state istituite come aventi proprietà sanitarie anche nell'antica Roma.
- 00: 09: 16 - La capacità del Sulforaphane di potenziare l'escrezione di cancerogeno (benzene, acroleina).
- 00: 09: 51 - NRF2 come interruttore genetico tramite elementi di risposta antiossidante.
- 00: 10: 10 - Come l'attivazione di NRF2 migliora l'escrezione di cancerogeno tramite glutatione-S-coniugati.
- 00: 10: 34 - I cavoletti di Bruxelles aumentano la glutatione-S-transferasi e riducono il danno al DNA.
- 00: 11: 20 - La bevanda di germogli di broccoli aumenta l'escrezione di benzene di 61%.
- 00: 13: 31 - L'omogenato di germogli di broccoli aumenta gli enzimi antiossidanti nelle vie aeree superiori.
- 00: 15: 45 - Consumo di verdure crocifere e mortalità per malattie cardiache.
- 00: 16: 55 - La polvere di germogli di broccoli migliora i lipidi nel sangue e il rischio complessivo di malattie cardiache nei diabetici di tipo 2.
- 00: 19: 04 - Inizio della sezione di invecchiamento.
- 00: 19: 21 - La dieta arricchita con sulforafano migliora la durata della vita dei coleotteri da 15 a 30% (in determinate condizioni).
- 00: 20: 34 - L'importanza della bassa infiammazione per la longevità.
- 00: 22: 05 - Le verdure crocifere e la polvere di germogli di broccoli sembrano ridurre un'ampia varietà di marcatori infiammatori negli esseri umani.
- 00: 23: 40 - Ricapitolazione di metà video: cancro, sezioni di invecchiamento
- 00: 24: 14 - Gli studi sui topi suggeriscono che il sulforafano potrebbe migliorare la funzione immunitaria adattativa in età avanzata.
- 00: 25: 18 - Sulforaphane ha migliorato la crescita dei peli in un modello murino di calvizie. Immagine su 00: 26: 10.
- 00: 26: 30 - Inizio della sezione cervello e comportamento.
- 00: 27: 18 - Effetto dell'estratto di germogli di broccoli sull'autismo.
- 00: 27: 48 - Effetto del glucorapanin sulla schizofrenia.
- 00: 28: 17 - Inizio della discussione sulla depressione (meccanismo e studi plausibili).
- 00: 31: 21 - Lo studio del mouse utilizzando 10 diversi modelli di depressione indotta da stress mostra sulforapano in modo simile efficace come fluoxetina (prozac).
- 00: 32: 00 - Lo studio mostra che l'ingestione diretta di glucorafanina nei topi è altrettanto efficace nel prevenire la depressione dal modello di stress sociale di sconfitta.
- 00: 33: 01 - Inizio della sezione di neurodegenerazione.
- 00: 33: 30 - Sulforaphane e malattia di Alzheimer.
- 00: 33: 44 - Sulforaphane e morbo di Parkinson.
- 00: 33: 51 - Sulforaphane e la malattia di Hungtington.
- 00: 34: 13 - Sulforaphane aumenta le proteine da shock termico.
- 00: 34: 43 - Inizio della sezione traumatica di lesioni cerebrali.
- 00: 35: 01 - Sulforaphane iniettato immediatamente dopo TBI migliora la memoria (studio del mouse).
- 00: 35: 55 - Sulforaphane e plasticità neuronale.
- 00: 36: 32 - Sulforaphane migliora l'apprendimento nel modello di diabete di tipo II nei topi.
- 00: 37: 19 - Distrofia muscolare sulforapano e duchenne.
- 00: 37: 44 - Inibizione della miostatina nelle cellule muscolari satelliti (in vitro).
- 00: 38: 06 - Ricapitolazione tardiva: mortalità e cancro, danno al DNA, stress ossidativo e infiammazione, escrezione di benzene, malattie cardiovascolari, diabete di tipo II, effetti sul cervello (depressione, autismo, schizofrenia, neurodegenerazione), via NRF2.
- 00: 40: 27 - Pensieri sulla determinazione di una dose di germogli di broccoli o sulforafano.
- 00: 41: 01 - Aneddoti su germinazione a casa.
- 00: 43: 14 - Sulle temperature di cottura e sull'attività del sulforafano.
- 00: 43: 45 - Conversione batterica intestinale del sulforafano da glucorafanina.
- 00: 44: 24 - Gli integratori funzionano meglio se combinati con la mirosinasi attiva delle verdure.
- 00: 44: 56 - Tecniche di cottura e verdure crucifere.
- 00: 46: 06 - Isotiocianati come goitrogens.

Nrf2 è un fattore di trascrizione che svolge un ruolo importante nel sistema di difesa antiossidante cellulare del corpo umano. L'elemento antiossidante reattivo, o ARE, è un meccanismo regolatore dei geni. Numerosi studi hanno dimostrato che Nrf2, o fattore 2 correlato a NF-E2, regola un'ampia varietà di geni basati su ARE in diversi tipi di cellule. È stato anche scoperto che Nrf2 svolge un ruolo essenziale nella protezione cellulare e nell'anti-cancerogenicità, dimostrando che Nrf2 può essere un trattamento efficace nella gestione delle malattie neurodegenerative e dei tumori che si ritiene siano causati dallo stress ossidativo. Dr. Alex Jimenez DC, CCST Insight
Osservazioni conclusive
Sebbene molte domande rimangano aperte, le prove sperimentali disponibili indicano chiaramente che Nrf2 è un attore importante nel mantenimento dell'omeostasi mitocondriale e dell'integrità strutturale. Questo ruolo diventa particolarmente critico in condizioni di stress ossidativo, elettrofilo e infiammatorio quando la capacità di sovraregolazione delle risposte citoprotettive mediate da Nrf2 influenza la salute generale e la sopravvivenza della cellula e dell'organismo. Il ruolo di Nrf2 nella funzione mitocondriale rappresenta un altro strato dei grandi meccanismi citoprotettivi orchestrati da questo fattore di trascrizione. Poiché molte condizioni patologiche umane hanno lo stress ossidativo, l'infiammazione e la disfunzione mitocondriale come componenti essenziali della loro patogenesi, l'attivazione farmacologica di Nrf2 è promettente per la prevenzione e il trattamento delle malattie. Comprensione completa dei meccanismi precisi con cui Nrf2 influenza la funzione mitocondriale è essenziale per la progettazione razionale di futuri studi clinici e può offrire nuovi biomarcatori per il monitoraggio dell'efficacia terapeutica.
Ringraziamenti
Sciencedirect.com/science/article/pii/S0891584915002129
Lo scopo dell'articolo sopra era quello di discutere, oltre a dimostrare, il ruolo emergente di Nrf2 nella funzione mitocondriale. Nrf2 o fattore nucleare fattore eritroide 2 correlato, è un regolatore emergente della resistenza cellulare agli ossidanti che possono contribuire allo stress ossidativo, influenzando la funzione cellulare e portando allo sviluppo di tossicità, malattie croniche e persino cancro. Mentre la produzione di ossidanti nel corpo umano può servire a vari scopi, tra cui la divisione cellulare, l'infiammazione, la funzione immunitaria, l'autofagia e la risposta allo stress, è essenziale controllare la loro sovrapproduzione per prevenire problemi di salute. Lo scopo delle nostre informazioni è limitato ai problemi di salute della colonna vertebrale e della chiropratica. Per discutere l'argomento, non esitate a chiedere al Dr. Jimenez o contattarci a 915-850-0900 .
A cura di Dr. Alex Jimenez
Riferito da: Sciencedirect.com

Discussione aggiuntiva sull'argomento: Dolore alla schiena acuto
Mal di schienaè una delle cause più diffuse di disabilità e di giornate di lavoro perse in tutto il mondo. Il dolore alla schiena si attribuisce alla seconda ragione più comune per le visite mediche, superata solo dalle infezioni delle alte vie respiratorie. Circa l'80% della popolazione sperimenterà dolore alla schiena almeno una volta nella vita. La colonna vertebrale è una struttura complessa composta da ossa, articolazioni, legamenti e muscoli, tra gli altri tessuti molli. Per questo motivo, lesioni e / o condizioni aggravate, come dischi erniciati, può eventualmente portare a sintomi di mal di schiena. Gli infortuni sportivi o gli incidenti automobilistici sono spesso la causa più frequente di mal di schiena, tuttavia, a volte il più semplice dei movimenti può avere risultati dolorosi. Fortunatamente, opzioni di trattamento alternative, come la cura chiropratica, possono aiutare ad alleviare il mal di schiena attraverso l'uso di aggiustamenti spinali e manipolazioni manuali, migliorando in definitiva il sollievo dal dolore.

EXTRA EXTRA | ARGOMENTO IMPORTANTE: consigliato El Paso, TX Chiropractor
***
Le informazioni qui riportate su "Il ruolo emergente di Nrf2 nella funzione mitocondriale" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale