Infiammazione neurogena, o NI, è il processo fisiologico in cui i mediatori vengono scaricati direttamente dai nervi cutanei per iniziare una risposta infiammatoria. Ciò si traduce nella creazione di reazioni infiammatorie locali tra cui, eritema, gonfiore, aumento della temperatura, dolorabilità e dolore. Le sottili fibre somatiche afferenti non mielinizzate, che rispondono alle stimolazioni meccaniche e chimiche a bassa intensità, sono in gran parte responsabili del rilascio di questi mediatori dell'infiammazione.
Quando stimolati, queste vie nervose nei nervi cutanei rilasciano i neuropeptidi energetici, o sostanza P e il peptide correlato al gene della calcitonina (CGRP), rapidamente nel microambiente, innescando una serie di risposte infiammatorie. C'è una significativa distinzione nell'infiammazione immunogenica, che è la prima risposta protettiva e riparativa del sistema immunitario quando un agente patogeno entra nel corpo, mentre l'infiammazione neurogena implica una connessione diretta tra il sistema nervoso e le risposte infiammatorie. Anche se l'infiammazione neurogena e l'infiammazione immunologica possono esistere contemporaneamente, i due non sono clinicamente indistinguibili. Lo scopo di questo articolo è di discutere il meccanismo dell'infiammazione neurogena e il ruolo del sistema nervoso periferico nella difesa dell'ospite e nell'immunopatologia.
Contenuti
Infiammazione neurogena - Il ruolo del sistema nervoso periferico nella difesa dell'ospite e nell'immunopatologia
Astratto
Il sistema nervoso e il sistema immunitario periferico sono tradizionalmente considerati come funzioni separate. Questa linea, tuttavia, sta diventando sempre più offuscata dalle nuove conoscenze sull'infiammazione neurogena. I neuroni nocicettori possiedono molte delle stesse vie di riconoscimento molecolare per il pericolo delle cellule immunitarie e in risposta al pericolo, il sistema nervoso periferico comunica direttamente con il sistema immunitario, formando un meccanismo protettivo integrato. La fitta rete di innervazione delle fibre sensoriali e autonomiche nei tessuti periferici e l'alta velocità di trasduzione neurale consente una rapida modulazione neurogenica locale e sistemica dell'immunità. Anche i neuroni periferici sembrano giocare un ruolo significativo nella disfunzione immunitaria nelle malattie autoimmuni e allergiche. Pertanto, la comprensione dell'interazione coordinata dei neuroni periferici con le cellule immunitarie può far avanzare approcci terapeutici per aumentare la difesa dell'ospite e sopprimere l'immunopatologia.
Introduzione
Duemila anni fa, Celso definì l'infiammazione come coinvolgente quattro segni cardinali: Dolor (dolore), Calor (calore), Rubor (arrossamento) e Tumore (gonfiore), un'osservazione che indicava che l'attivazione del sistema nervoso era riconosciuta come parte integrante del infiammazione. Tuttavia, il dolore è stato pensato principalmente da allora, solo come un sintomo e non come un partecipante alla generazione dell'infiammazione. In questa prospettiva, dimostriamo che il sistema nervoso periferico svolge un ruolo diretto e attivo nel modulare l'immunità innata e adattativa, in modo tale che i sistemi immunitario e nervoso possano avere una funzione protettiva integrata comune nella difesa dell'ospite e nella risposta al danno tissutale, un intricato interazione che può anche portare a patologie nelle malattie allergiche e autoimmuni.
La sopravvivenza degli organismi dipende in modo critico dalla capacità di montare una difesa contro potenziali danni causati da danni ai tessuti e infezioni. La difesa dell'ospite coinvolge sia il comportamento di evitamento per rimuovere il contatto con un ambiente pericoloso (nocivo) (una funzione neurale), sia la neutralizzazione attiva dei patogeni (una funzione immunitaria). Tradizionalmente, il ruolo del sistema immunitario nella lotta agli agenti infettivi e nella riparazione delle lesioni tissutali è stato considerato abbastanza distinto da quello del sistema nervoso, che trasduce i segnali ambientali e interni dannosi in attività elettrica per produrre sensazioni e riflessi (Fig.1). Proponiamo che questi due sistemi siano effettivamente componenti di un meccanismo di difesa unificato. Il sistema nervoso somatosensoriale è nella posizione ideale per rilevare il pericolo. In primo luogo, tutti i tessuti altamente esposti all'ambiente esterno, come le superfici epiteliali della pelle, dei polmoni, del tratto urinario e digerente, sono densamente innervati dai nocicettori, fibre sensoriali ad alta soglia che producono dolore. In secondo luogo, la trasduzione di stimoli esterni nocivi è quasi istantanea, ordini di grandezza più rapida della mobilitazione del sistema immunitario innato, e quindi può essere il `` primo responder '' nella difesa dell'ospite.
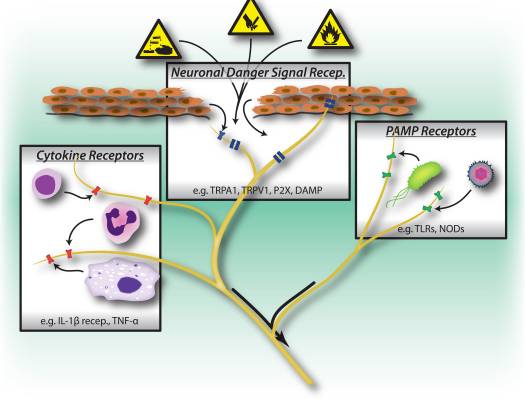
Figura 1: Stimoli nocivi, percorsi di riconoscimento microbico e infiammatorio innescano l'attivazione del sistema nervoso periferico. I neuroni sensoriali possiedono diversi mezzi per rilevare la presenza di stimoli nocivi / nocivi. 1) I recettori del segnale di pericolo, compresi i canali TRP, i canali P2X ei recettori del pattern molecolare (DAMP) associati al pericolo riconoscono i segnali esogeni dall'ambiente (ad esempio calore, acidità, sostanze chimiche) o segnali di pericolo endogeni rilasciati durante il trauma / lesioni tissutali (ad es. ATP, acido urico, idrossinonali). 2) I recettori di riconoscimento del modello (PRR) come i recettori Toll-like (TLR) e recettori Nod-like (NLR) riconoscono i pattern molecolari associati al patogeno (PAMP) liberati dall'invasione di batteri o virus durante l'infezione. 3) I recettori delle citochine riconoscono i fattori secreti dalle cellule immunitarie (es. IL-1beta, TNF-alfa, NGF), che attivano le chinasi della mappa e altri meccanismi di segnalazione per aumentare l'eccitabilità della membrana.
Oltre agli input ortodromici al midollo spinale e al cervello dalla periferia, i potenziali d'azione nei neuroni nocicettori possono anche essere trasmessi antidromicamente ai punti di diramazione fino alla periferia, il riflesso dell'assone. Questi, insieme a depolarizzazioni locali sostenute, portano a un rilascio rapido e locale di mediatori neurali sia dagli assoni periferici che dai terminali (Fig. 2) 1. Esperimenti classici di Goltz (nel 1874) e di Bayliss (nel 1901) hanno mostrato che le radici dorsali elettricamente stimolanti induce vasodilatazione cutanea, che ha portato al concetto di infiammazione neurogena , indipendente da quella prodotta dal sistema immunitario (Fig.3).
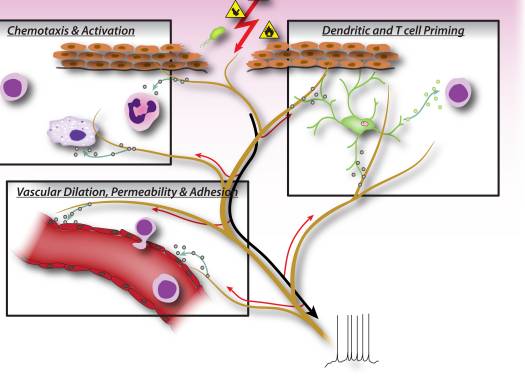
Figura 2: I fattori neuronali rilasciati dai neuroni sensoriali nocicettori guidano direttamente la chemiotassi dei leucociti, l'emodinamica vascolare e la risposta immunitaria. Quando stimoli nocivi attivano segnali afferenti nei nervi sensoriali, vengono generati riflessi assonici antidromici che inducono il rilascio di neuropeptidi ai terminali periferici dei neuroni. Questi mediatori molecolari hanno diverse azioni infiammatorie: 1) chemiotassi e attivazione di neutrofili, macrofagi e linfociti nel sito di lesione e degranulazione di mastociti. 2) Segnalazione alle cellule endoteliali vascolari per aumentare il flusso sanguigno, perdite vascolari ed edema. Ciò consente anche un più facile reclutamento di leucociti infiammatori. 3) Adescamento delle cellule dendritiche per guidare la successiva differenziazione delle cellule T helper nei sottotipi Th2 o Th17.

Figura 3: Cronologia dei progressi nella comprensione degli aspetti neurogenici dell'infiammazione da Celso fino ai giorni nostri.
L'infiammazione neurogena è mediata dal rilascio dei neuropeptidi del peptide correlato al gene della calcitonina (CGRP) e della sostanza P (SP) dai nocicettori, che agiscono direttamente sulle cellule endoteliali vascolari e sulla muscolatura liscia 2�5. CGRP produce effetti di vasodilatazione 2, 3, mentre SP aumenta la permeabilità capillare portando a stravaso di plasma ed edema 4, 5, contribuendo al rubor, al calor e al tumore di Celso. Tuttavia, i nocicettori rilasciano molti neuropeptidi aggiuntivi (database online: www.neuropeptides.nl/), tra cui adrenomedullina, neurocinine A e B, peptide intestinale vasoattivo (VIP), neuropeptide (NPY) e peptide di rilascio della gastrina (GRP), nonché altri mediatori molecolari come glutammato, ossido nitrico (NO) e citochine come eotassina 6.
Ora ci rendiamo conto che i mediatori rilasciati dai neuroni sensoriali nella periferia non solo agiscono sul sistema vascolare, ma attraggono e attivano anche direttamente le cellule immunitarie innate (mastociti, cellule dendritiche) e le cellule immunitarie adattative (linfociti T) 7-12. Nel contesto acuto del danno tissutale, ipotizziamo che l'infiammazione neurogena sia protettiva, facilitando la guarigione fisiologica delle ferite e la difesa immunitaria contro i patogeni attivando e reclutando le cellule immunitarie. Tuttavia, tali comunicazioni neuroimmuni probabilmente svolgono anche un ruolo importante nella fisiopatologia delle malattie allergiche e autoimmuni amplificando le risposte immunitarie patologiche o disadattive. In modelli animali di artrite reumatoide, ad esempio, Levine e colleghi hanno dimostrato che la denervazione dell'articolazione porta a una notevole attenuazione dell'infiammazione, che dipende dall'espressione neurale della sostanza P 13, 14. In recenti studi sull'infiammazione delle vie aeree allergiche, colite e psoriasi, i neuroni sensoriali primari svolgono un ruolo centrale nell'avvio e nell'aumento dell'attivazione dell'immunità innata e adattativa 15-17.
Proponiamo quindi che il sistema nervoso periferico svolga non solo un ruolo passivo nella difesa dell'ospite (rilevamento di stimoli nocivi e avvio del comportamento di evitamento), ma anche un ruolo attivo in concerto con il sistema immunitario nel modulare le risposte e il stimoli, un ruolo che può essere sovvertito a contribuire alla malattia.
Percorsi di riconoscimento dei pericoli condivisi nei sistemi immunitari periferici nervosi e innati
I neuroni sensoriali periferici sono adattati a riconoscere il pericolo per l'organismo in virtù della loro sensibilità a stimoli chimici meccanici, termici e irritanti intensi (Fig. 1). I canali ionici del potenziale transitorio recettoriale (TRP) sono i mediatori molecolari più studiati della nocicezione, conducendo l'ingresso non selettivo dei cationi all'attivazione da parte di vari stimoli nocivi. TRPV1 viene attivato da alte temperature, pH basso e capsaicina, il componente irritante vallinoide del peperoncino 18. TRPA1 media l'individuazione di sostanze chimiche reattive tra cui irritanti ambientali come gas lacrimogeni e isotiocianati industriali 19, ma, cosa più importante, è anche attivato durante lesioni tissutali da segnali molecolari endogeni tra cui 4-idrossinonenale e prostaglandine 20, 21.
È interessante notare che i neuroni sensoriali condividono molte delle stesse vie del recettore del riconoscimento molecolare dei patogeni e dei pericoli come cellule immunitarie innate, che consentono loro anche di rilevare i patogeni (Fig. 1). Nel sistema immunitario, i patogeni microbici vengono rilevati dai recettori di riconoscimento del pattern (PRR) codificati germinali, che riconoscono pattern molecolari associati a patogeni esogeni ampiamente conservati (PAMP). I primi PRR da identificare erano membri della famiglia dei recettori toll-like (TLR), che si legano ai lieviti, ai componenti delle pareti cellulari derivate da batteri e all'RNA virale 22. Dopo l'attivazione della PRR, vengono attivati i percorsi di segnalazione a valle che inducono la produzione di citochine e l'attivazione dell'immunità adattativa. Oltre ai TLR, le cellule immunitarie innate vengono attivate durante lesioni tissutali da segnali di pericolo derivati endogeni, noti anche come pattern molecolari associati al danno (DAMP) o allarmi 23, 24. Questi segnali di pericolo includono HMGB1, acido urico e proteine da shock termico rilasciati dalle cellule morenti durante la necrosi, attivando le cellule immunitarie durante risposte infiammatorie non infettive.
I PRR inclusi i TLR 3, 4, 7 e 9 sono espressi dai neuroni nocicettori e la stimolazione da parte dei ligandi TLR porta all'induzione di correnti interne e alla sensibilizzazione dei nocicettori ad altri stimoli dolorosi 25. Inoltre, l'attivazione dei neuroni sensoriali da parte del ligando TLR27 imiquimod porta all'attivazione di una via sensoriale specifica per il prurito 7. Questi risultati indicano che il dolore e il prurito associati all'infezione possono essere in parte dovuti all'attivazione diretta dei neuroni da parte di fattori patogeni, che a loro volta attivare le cellule immunitarie attraverso il rilascio periferico di molecole di segnalazione neuronale.
Un importante DAMP / alarmin rilasciato durante il danno cellulare è l'ATP, che è riconosciuto dai recettori purinergici sia sui neuroni nocicettori che sulle cellule immunitarie 28-30. I recettori purinergici sono costituiti da due famiglie: recettori P2X, canali cationici legati al ligando e recettori P2Y, recettori accoppiati a proteine G. Nei neuroni nocicettori, il riconoscimento dell'ATP avviene attraverso P2X3, portando a correnti cationiche rapidamente densificanti e dolore 28, 30 (Fig.1), mentre i recettori P2Y contribuiscono all'attivazione dei nocicettori mediante la sensibilizzazione del TRP e dei canali del sodio voltaggio-dipendenti. Nei macrofagi, il legame dell'ATP ai recettori P2X7 porta all'iperpolarizzazione e all'attivazione a valle dell'inflammasoma, un complesso molecolare importante nella generazione di IL-1beta e IL-18 29. Pertanto, l'ATP è un potente segnale di pericolo che attiva sia i neuroni periferici che quelli innati. immunità durante la lesione, e alcune prove suggeriscono addirittura che i neuroni esprimano parti del macchinario molecolare dell'inflammasoma 31.
Il rovescio della medaglia dei segnali di pericolo nei nocicettori è il ruolo dei canali TRP nell'attivazione delle cellule immunitarie. TRPV2, un omologo di TRPV1 attivato da calore nocivo, è espresso ad alti livelli nelle cellule immunitarie innate 32. L'ablazione genetica di TRPV2 ha portato a difetti nella fagocitosi dei macrofagi e nella clearance delle infezioni batteriche 32. I mastociti esprimono anche i canali TRPV, che possono mediare direttamente la loro degranulazione 33. Resta da stabilire se i segnali di pericolo endogeno attivino le cellule immunitarie in modo simile ai nocicettori.
Un mezzo chiave di comunicazione tra cellule immunitarie e neuroni nocicettori è attraverso le citochine. Dopo l'attivazione dei recettori delle citochine, le vie di trasduzione del segnale vengono attivate nei neuroni sensoriali che portano alla fosforilazione a valle delle proteine di membrana tra cui TRP e canali voltaggio-dipendenti (Fig.1). La conseguente sensibilizzazione dei nocicettori significa che stimoli meccanici e termici normalmente innocui possono ora attivare i nocicettori. L'interleuchina 1 beta e il TNF-alfa sono due importanti citochine rilasciate dalle cellule immunitarie innate durante l'infiammazione. IL-1beta e TNF-alfa sono rilevati direttamente dai nocicettori che esprimono i recettori affini, inducono l'attivazione delle chinasi della mappa p38 che portano ad una maggiore eccitabilità di membrana 34. Anche il fattore di crescita nervoso (NGF) e la prostaglandina E (36) sono i principali mediatori dell'infiammazione rilasciati dalle cellule immunitarie che agiscono direttamente sui neuroni sensoriali periferici per provocare la sensibilizzazione. Un effetto importante della sensibilizzazione ai nocicettori da parte dei fattori immunitari è un aumento del rilascio di neuropeptidi ai terminali periferici che attivano ulteriormente le cellule immunitarie, inducendo così un ciclo di feedback positivo che guida e facilita l'infiammazione.
Controllo sensoriale del sistema nervoso di immunità innata e adattativa
Nelle prime fasi dell'infiammazione, i neuroni sensoriali segnalano ai mastociti e alle cellule dendritiche residenti nei tessuti, che sono cellule immunitarie innate importanti per avviare la risposta immunitaria (Fig. 2). Studi anatomici hanno mostrato un'apposizione diretta dei terminali con i mastociti, così come con le cellule dendritiche, e i neuropeptidi rilasciati dai nocicettori possono indurre degranulazione o produzione di citochine in queste cellule 7, 9, 37. Questa interazione gioca un ruolo importante nelle vie aeree allergiche infiammazioni e dermatiti 10 12.
Durante la fase effettrice dell'infiammazione, le cellule immunitarie devono trovare la loro strada verso il sito specifico della lesione. Molti mediatori rilasciati da neuroni sensoriali, neuropeptidi, chemochine e glutammato sono chemiotattici per neutrofili, eosinofili, macrofagi e cellule T e migliorano l'adesione endoteliale che facilita l'homing delle cellule immunitarie 6, 38-41 (Fig.2). Inoltre, alcune prove implicano che i neuroni possano partecipare direttamente alla fase effettrice, poiché i neuropeptidi stessi possono avere funzioni antimicrobiche dirette 42.
Le molecole di segnalazione di derivazione neuronale possono anche dirigere il tipo di infiammazione, contribuendo alla differenziazione o alla specificazione di diversi tipi di cellule T immunitarie adattive. Un antigene viene fagocitato ed elaborato da cellule immunitarie innate, che poi migrano al linfonodo più vicino e presentano il peptide antigenico ai linfociti T na ve. A seconda del tipo di antigene, delle molecole costimolatorie sulla cellula immunitaria innata e delle combinazioni di citochine specifiche, le cellule T na ve maturano in sottotipi specifici che meglio servono allo sforzo infiammatorio per eliminare lo stimolo patogeno. Le cellule T CD4, o cellule T helper (Th), possono essere suddivise in quattro gruppi principali, Th1, Th2, Th17 e cellule regolatrici T (Treg). Le cellule Th1 sono principalmente coinvolte nella regolazione delle risposte immunitarie ai microrganismi intracellulari e alle malattie autoimmuni organo-specifiche; I Th2 sono fondamentali per l'immunità contro i patogeni extracellulari, come gli elminti, e sono responsabili di malattie infiammatorie allergiche; Le cellule Th17 svolgono un ruolo centrale nella protezione contro le sfide microbiche, come batteri e funghi extracellulari; Le cellule Treg sono coinvolte nel mantenimento dell'autotolleranza e nella regolazione delle risposte immunitarie. Questo processo di maturazione delle cellule T sembra essere fortemente influenzato dai mediatori neuronali sensoriali. I neuropeptidi, come CGRP e VIP, possono polarizzare le cellule dendritiche verso un'immunità di tipo Th2 e ridurre l'immunità di tipo Th1 promuovendo la produzione di alcune citochine e inibendone altre, nonché riducendo o migliorando la migrazione delle cellule dendritiche ai linfonodi locali 8 , 10, 43. I neuroni sensoriali contribuiscono anche considerevolmente all'infiammazione allergica (principalmente guidata da Th2) 17. Oltre a regolare le cellule Th1 e Th2, altri neuropeptidi, come SP e Hemokinin-1, possono guidare la risposta infiammatoria più verso Th17 o Treg 44, 45, il che significa che i neuroni possono anche essere coinvolti nella regolazione della risoluzione infiammatoria. Nelle immunopatologie come la colite e la psoriasi, il blocco dei mediatori neuronali come la sostanza P può smorzare in modo significativo i linfociti T e il danno immunomediato 15-17, sebbene antagonizzare un mediatore possa di per sé avere solo un effetto limitato sull'infiammazione neurogena.
Considerando che le molecole di segnalazione rilasciate dalle fibre nervose sensoriali periferiche regolano non solo i piccoli vasi sanguigni, ma anche la chemiotassi, l'homing, la maturazione e l'attivazione delle cellule immunitarie, sta diventando chiaro che le interazioni neuro-immuni sono molto più complesse di quanto si pensasse (Fig. 2). Inoltre, è abbastanza plausibile che non siano i singoli mediatori neurali, ma piuttosto combinazioni specifiche di molecole di segnalazione rilasciate dai nocicettori che influenzano diversi stadi e tipi di risposte immunitarie.
Controllo del riflesso autonomo dell'immunità
Appare anche prominente un ruolo per un circuito di "riflesso" del sistema nervoso autonomo colinergico nella regolazione delle risposte immunitarie periferiche 46. Il vago è il principale nervo parasimpatico che collega il tronco cerebrale con gli organi viscerali. Il lavoro di Kevin Tracey e altri indicano potenti risposte antinfiammatorie generalizzate nello shock settico e nell'endotossiemia, innescate da un'attività efferente del nervo vagale che porta a una soppressione dei macrofagi periferici 47. Il vago attiva i neuroni gangliari celiaci periferici che innervano la milza, portando al rilascio a valle di acetilcolina, che si lega ai recettori nicotinici alfa-49 sui macrofagi nella milza e nel tratto gastrointestinale. Ciò induce l'attivazione della via di segnalazione SOCS7 JAK2 / STAT3, che sopprime potentemente la trascrizione del TNF-alfa 3. Il ganglio adrenergico celiaco comunica anche direttamente con un sottoinsieme di cellule T della memoria che producono acetilcolina, che sopprimono i macrofagi infiammatori 47.
Le cellule T killer naturali invarianti (iNKT) sono un sottoinsieme specializzato di cellule T che riconoscono i lipidi microbici nel contesto di CD1d invece di antigeni peptidici. Le cellule NKT sono una popolazione chiave di linfociti coinvolti nel combattimento di agenti patogeni infettivi e nella regolazione dell'immunità sistemica. Le cellule NKT risiedono e si spostano principalmente attraverso la vascolatura e le sinusoidi della milza e del fegato. I nervi simpatici beta-adrenergici nel fegato segnalano direttamente per modulare l'attività delle cellule NKT 50. Nel corso di un modello murino di ictus (MCAO), ad esempio, la mobilità delle cellule NKT del fegato è stata visibilmente soppressa, che è stata invertita da denervazione simpatica o antagonisti beta-adrenergici. Inoltre, questa attività immunosoppressiva dei neuroni noradrenergici sulle cellule NKT ha portato ad un aumento delle infezioni sistemiche e delle lesioni polmonari. Pertanto, i segnali efferenti dei neuroni autonomi possono mediare una potente immuno-soppressione.

Insight di Dr. Alex Jimenez
L'infiammazione neurogena è una risposta infiammatoria locale generata dal sistema nervoso. Si ritiene che svolga un ruolo fondamentale nella patogenesi di una varietà di problemi di salute, tra cui emicrania, psoriasi, asma, fibromialgia, eczema, rosacea, distonia e sensibilità chimica multipla. Sebbene l'infiammazione neurogena associata al sistema nervoso periferico sia stata ampiamente studiata, il concetto di infiammazione neurogena all'interno del sistema nervoso centrale necessita ancora di ulteriori ricerche. Secondo diversi studi di ricerca, tuttavia, si ritiene che le carenze di magnesio siano la causa principale dell'infiammazione neurogena. Il seguente articolo mostra una panoramica dei meccanismi dell'infiammazione neurogena nel sistema nervoso, che può aiutare gli operatori sanitari a determinare il miglior approccio terapeutico per la cura di una varietà di problemi di salute associati al sistema nervoso.
Conclusioni
Quali sono i rispettivi ruoli specifici dei sistemi nervoso somatosensoriale e autonomo nella regolazione dell'infiammazione e del sistema immunitario (Fig.4)? L'attivazione dei nocicettori porta ai riflessi assonici locali, che reclutano e attivano localmente le cellule immunitarie ed è quindi principalmente pro-infiammatori e spazialmente confinati. Al contrario, la stimolazione autonomica porta a un'immunosoppressione sistemica influenzando i pool di cellule immunitarie nel fegato e nella milza. I meccanismi di segnalazione afferente nella periferia che portano all'attivazione del circuito riflesso colinergico vagale immunosoppressore sono poco conosciuti. Tuttavia, l'80-90% delle fibre vagali sono fibre sensoriali afferenti primarie, e quindi i segnali provenienti dai visceri, molti potenzialmente guidati dalle cellule immunitarie, possono portare all'attivazione degli interneuroni nel tronco cerebrale e attraverso di essi a un'uscita nelle fibre vagali efferenti 46.
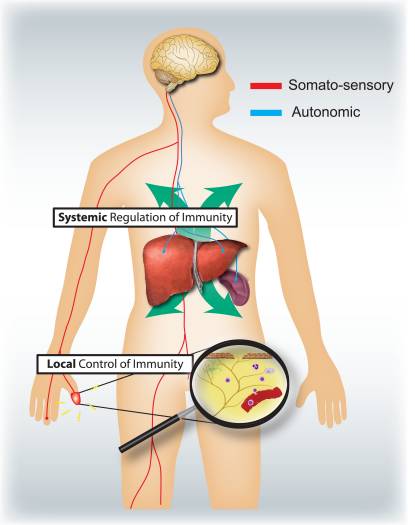
Figura 4: I sistemi nervosi sensoriali e autonomi modulano rispettivamente le risposte immunitarie locali e sistemiche. I nocicettori che innervano le superfici epiteliali (ad es. Pelle e polmone) inducono risposte infiammatorie localizzate, attivando mastociti e cellule dendritiche. Nell'infiammazione delle vie aeree allergiche, nella dermatite e nell'artrite reumatoide, i neuroni nocicettori svolgono un ruolo nel guidare l'infiammazione. Al contrario, i circuiti autonomici che innervano gli organi viscerali (ad esempio milza e fegato) regolano le risposte immunitarie sistemiche bloccando l'attivazione delle cellule NKT e dei macrofagi. In endotossemia cerebrale e settica, questi neuroni svolgono un ruolo immunosoppressivo.
In genere, il corso del tempo e la natura dell'infiammazione, sia durante l'infezione, le reazioni allergiche o patologie autoimmuni, sono definiti dalle categorie di cellule immunitarie coinvolte. Sarà importante sapere quali diversi tipi di cellule immunitarie sono regolate da segnali sensoriali e autonomi. Una valutazione sistematica di ciò che i mediatori possono essere rilasciati dai nocicettori e dai neuroni autonomici e l'espressione dei recettori per questi da differenti cellule immunitarie innate e adattative potrebbe aiutare a rispondere a questa domanda.
Durante l'evoluzione, si sono sviluppati percorsi molecolari di rilevamento di pericolo simili sia per l'immunità innata che per la nocicezione anche se le cellule hanno linee di sviluppo completamente diverse. Mentre i PRR e i canali ionici legati ai leganti nocivi sono studiati separatamente da immunologi e neurobiologi, il confine tra questi due campi è sempre più sfocato. Durante il danno tissutale e l'infezione patogena, è probabile che il rilascio di segnali di pericolo porti ad un'attivazione coordinata sia dei neuroni periferici che delle cellule immunitarie con una comunicazione bidirezionale complessa e una difesa dell'ospite integrata. Il posizionamento anatomico dei nocicettori all'interfaccia con l'ambiente, la velocità di trasduzione neurale e la loro capacità di rilasciare potenti cocktail di mediatori ad azione immunitaria consentono al sistema nervoso periferico di modulare attivamente la risposta immunitaria innata e coordinare l'immunità adattativa a valle. Al contrario, i nocicettori sono altamente sensibili ai mediatori immunitari, che attivano e sensibilizzano i neuroni. L'infiammazione neurogena e quella immunomediata non sono, quindi, entità indipendenti, ma agiscono insieme come dispositivi di allarme precoce. Tuttavia, il sistema nervoso periferico svolge anche un ruolo importante nella fisiopatologia, e forse eziologia, di molte malattie immunitarie come asma, psoriasi o colite perché la sua capacità di attivare il sistema immunitario può amplificare l'infiammazione patologica 15-17. Il trattamento per i disturbi immunitari può richiedere, quindi, di includere il targeting dei nocicettori e delle cellule immunitarie.
Ringraziamenti
Ringraziamo il NIH per il supporto (2R37NS039518).
In conclusione,Comprendere il ruolo dell'infiammazione neurogena quando si tratta di difesa dell'ospite e immunopatologia è essenziale per determinare l'approccio terapeutico appropriato per una varietà di problemi di salute del sistema nervoso. Osservando le interazioni dei neuroni periferici con le cellule immunitarie, gli operatori sanitari possono far progredire approcci terapeutici per aumentare ulteriormente la difesa dell'ospite e sopprimere l'immunopatologia. Lo scopo dell'articolo sopra è quello di aiutare i pazienti a comprendere la neurofisiologia clinica della neuropatia, tra gli altri problemi di salute delle lesioni nervose. Informazioni referenziate dal National Center for Biotechnology Information (NCBI). Lo scopo delle nostre informazioni è limitato alla chiropratica e alle lesioni e condizioni della colonna vertebrale. Per discutere l'argomento, non esitate a chiedere al Dr. Jimenez o contattarci a 915-850-0900 .
A cura di Dr. Alex Jimenez
Argomenti aggiuntivi: Dolore alla schiena
Mal di schiena è una delle cause prevalenti di disabilità e giornate perse al lavoro in tutto il mondo. Di fatto, il dolore alla schiena è stato attribuito come la seconda ragione più comune per le visite di un medico, superata solo dalle infezioni delle alte vie respiratorie. Circa il 80 percento della popolazione sperimenterà qualche tipo di dolore alla schiena almeno una volta nel corso della vita. La colonna vertebrale è una struttura complessa composta da ossa, articolazioni, legamenti e muscoli, tra gli altri tessuti molli. A causa di ciò, lesioni e / o condizioni aggravate, come dischi erniciati, può eventualmente portare a sintomi di mal di schiena. Le lesioni sportive o gli incidenti automobilistici sono spesso la causa più frequente di mal di schiena, tuttavia a volte il più semplice dei movimenti può avere risultati dolorosi. Fortunatamente, le opzioni di trattamento alternative, come la cura chiropratica, possono aiutare ad alleviare il mal di schiena attraverso l'uso di aggiustamenti spinali e manipolazioni manuali, in definitiva migliorando il sollievo dal dolore.

ARGOMENTO PIÙ IMPORTANTE: Gestione del mal di schiena
ALTRI ARGOMENTI: EXTRA EXTRA: Dolore cronico e trattamenti
luminoso
Riferimenti
Chiudi fisarmonica
Le informazioni qui riportate su "Il ruolo dell'infiammazione neurogena" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale