Tiroide e malattie autoimmuni:
Parole Chiave:
- Malattia tiroidea autoimmune
- Sigarette
- I fattori ambientali
- Fattori endogeni
- Ipotesi di acceleratore
- Assunzione di selenio
- Assunzione di iodio
Astratto
La ghiandola tiroidea gioca un ruolo importante nel corpo umano; produce gli ormoni necessari per livelli di energia appropriati e una vita attiva. Questi ormoni hanno un impatto critico sullo sviluppo iniziale del cervello e sulla crescita somatica. Allo stesso tempo, la tiroide è altamente vulnerabile alle malattie della tiroide autoimmuni (AITD). Si verificano a causa della complessa interazione di fattori genetici, ambientali ed endogeni e la combinazione specifica è necessaria per avviare l'autoimmunità tiroidea. Quando la cellula tiroidea diventa il bersaglio dell'autoimmunità, interagisce con il sistema immunitario e sembra influenzare la progressione della malattia. Può produrre diversi fattori di crescita, molecole di adesione e una vasta gamma di citochine. Fattori ambientali prevenibili, tra cui un'elevata assunzione di iodio, carenza di selenio e inquinanti come il fumo di tabacco, nonché malattie infettive e alcuni farmaci, sono stati implicati nello sviluppo di AITD in individui geneticamente predisposti. La suscettibilità della tiroide agli AITD può derivare dalla complessità della sintesi ormonale, dai requisiti peculiari degli oligoelementi e dalle capacità specifiche del sistema di difesa delle cellule tiroidee. Una migliore comprensione di questa interazione potrebbe produrre novitàpercorsi di trattamento, alcuni dei quali potrebbero essere semplici come identificare la necessità di evitare il fumo o controllare l'assunzione di alcuni nutrienti.
Contenuti
Introduzione
La ghiandola tiroidea è importante nel corpo umano a causa della sua capacità di produrre ormoni necessari per livelli di energia adeguati e una vita attiva. Queste molecole hanno effetti pleiotropici, giocano ruoli critici nello sviluppo precoce del cervello, nella crescita somatica, nella maturazione ossea e nella sintesi dell'mRNA di più di proteine 100 che regolano costantemente ogni funzione del corpo.
Allo stesso tempo, la tiroide è altamente vulnerabile alle malattie autoimmuni. L'incidenza della tiroidite autoimmune cronica (CAT) e della malattia di Graves (GD) è aumentata drasticamente negli ultimi decenni, affliggendo fino al 5% della popolazione generale. Nei bambini, la CAT è la causa più comune di ipotiroidismo acquisito nelle aree gozzo non endemiche.
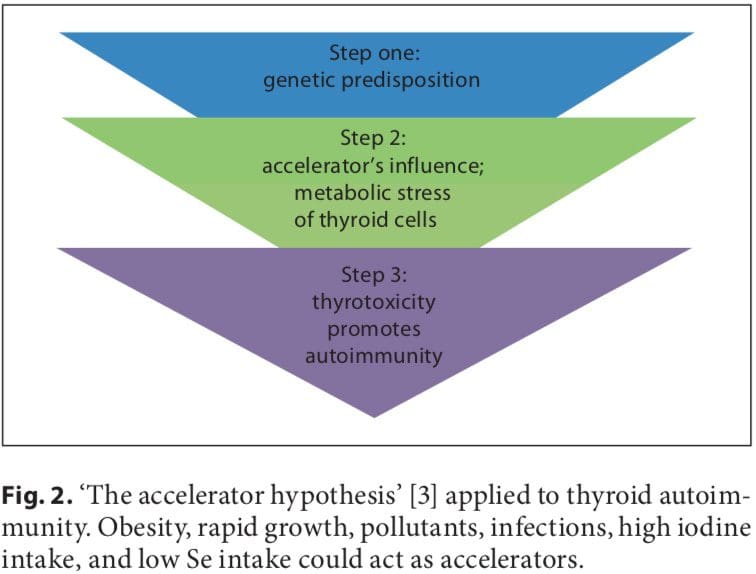
Gli studi iniziali sull'associazione tra nutrizione fetale precoce e patogenesi delle malattie tiroidee autoimmuni (AITD) hanno prodotto dati controversi. Negli studi sui gemelli, Phillips et al. [1] hanno scoperto che tra i gemelli monozigoti il gemello più piccolo aveva livelli più elevati di anticorpi per ossidasi tiroidea (TPO). Tuttavia, questi dati non lo eranoconfermato in un altro studio sui gemelli in cui è stata analizzata una coorte più ampia [2]. L'ipotesi dell'acceleratore e l'influenza della rapida crescita infantile dovuta allo squilibrio di cibo e adipochine denso di energia non sono state studiate negli AITD infantili. Sia nel diabete di tipo 1 che in quello di tipo 2, l'ipotesi dell'acceleratore propone un'influenza critica dell'obesità come fattore esogeno che contribuisce alla malattia; anche in una popolazione di bambini con diabete di tipo 1, i più grassi presentavano la malattia per prima (evidenza di una vera accelerazione) [3]. Per quanto riguarda gli AITD, altri acceleratori oltre all'obesità includono un basso selenio (Se) e un'elevata assunzione di iodio. I bambini obesi sono iperleptinemici e la leptina, con le sue numerose funzioni tra cui la promozione delle risposte immunitarie cellulo-mediate, è un buon candidato per contribuire alla patogenesi delle malattie autoimmuni. È stato riscontrato che i bambini obesi hanno un aumento delle cellule T helper che secernono l'interferone (IFN) e alterata la struttura tiroidea e lo stato ormonale [4 8].
L'autoimmunità è generalmente considerata solo una causa di malattia; tuttavia, i repertori di cellule T umane comprendono naturalmente linfociti autoimmuni. Le cellule T autoimmuni possono aiutare a guarire i tessuti danneggiati, indicando che l'autoimmunità naturale può anche contribuire alla salute e favorire l'auto-manutenzione [9]. Il sistema immunitario prende le sue decisioni e agisce integrando più signali in un dialogo continuo con i tessuti. È probabile che il tessuto stesso fornisca segnali che attivano il tipo di infiammazione necessario per l'auto-manutenzione dei tessuti e la riparazione [9, 10].
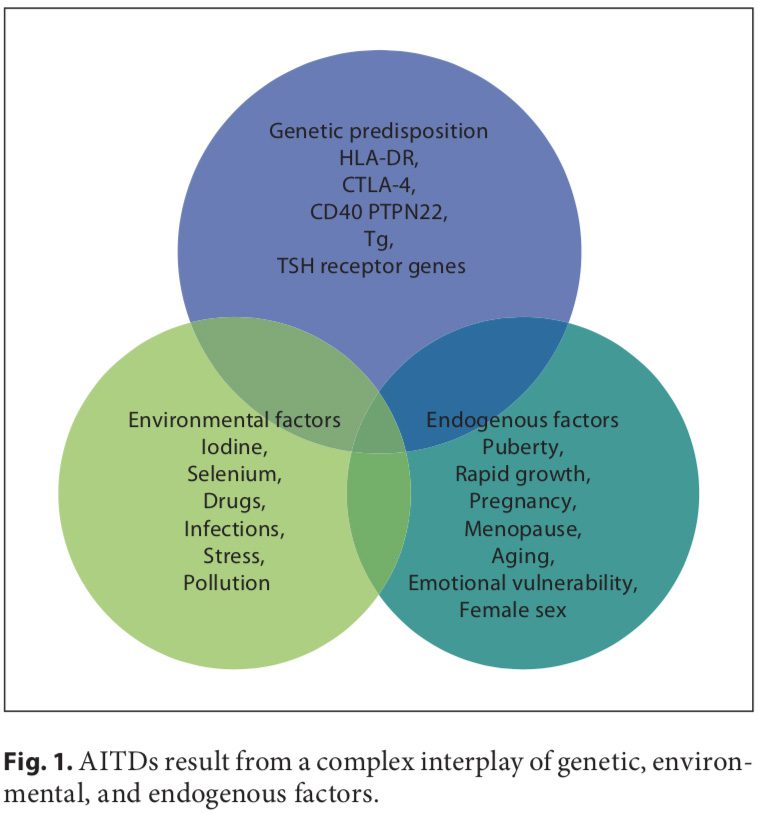 I disturbi autoimmuni derivano da una complessa interazione di fattori genetici, ambientali ed endogeni (figura 1), e una combinazione di questi fattori è necessaria per iniziare l'autoimmunità tiroidea [11, 12]. I recenti progressi negli studi su tutto il genoma hanno reso possibile identificare efficacemente geni associati a malattie complesse. Utilizzando sia l'approccio del gene candidato che gli studi di linkaggio dell'intero genoma, sono stati identificati e confermati i geni di suscettibilità 6 AITD; il primo gruppo comprende i prodotti genici immunomodulatori HLA-DR, CD40, il fattore associato ai linfociti T citotossici (CTLA-4) e la tirosina fosfatasi 22 (PTPN22), e il secondo gruppo comprende i prodotti genici tiroidei specifici tireoglobulina (Tg) e recettore dell'ormone stimolante la tiroide (TSHR). I fattori genetici predominano, calcolando approssimativamente il 80% della probabilità di sviluppare AITD, mentre almeno il 20% è dovuto a fattori ambientali (figura 1). Negli ultimi anni sono state pubblicate numerose recensioni eccellenti sul background genetico degli AITD [13, 14].
I disturbi autoimmuni derivano da una complessa interazione di fattori genetici, ambientali ed endogeni (figura 1), e una combinazione di questi fattori è necessaria per iniziare l'autoimmunità tiroidea [11, 12]. I recenti progressi negli studi su tutto il genoma hanno reso possibile identificare efficacemente geni associati a malattie complesse. Utilizzando sia l'approccio del gene candidato che gli studi di linkaggio dell'intero genoma, sono stati identificati e confermati i geni di suscettibilità 6 AITD; il primo gruppo comprende i prodotti genici immunomodulatori HLA-DR, CD40, il fattore associato ai linfociti T citotossici (CTLA-4) e la tirosina fosfatasi 22 (PTPN22), e il secondo gruppo comprende i prodotti genici tiroidei specifici tireoglobulina (Tg) e recettore dell'ormone stimolante la tiroide (TSHR). I fattori genetici predominano, calcolando approssimativamente il 80% della probabilità di sviluppare AITD, mentre almeno il 20% è dovuto a fattori ambientali (figura 1). Negli ultimi anni sono state pubblicate numerose recensioni eccellenti sul background genetico degli AITD [13, 14].
Un aumento della frequenza di AITD è riportato nella sindrome di Turner (TS) e in altri disturbi cromosomici non disgiunzionali come le sindromi di Down e Klinefelter. La teoria secondo cui l'autoimmunità materna può portare alla sopravvivenza preferenziale di un feto con aneuploidia cromosomica è attraente ma rimane non dimostrata [15]. La malattia autoimmune più diffusa nella TS sembra essere la CAT, con un'incidenza di autoanticorpi tiroidei segnalata del 30-50%. L'ipotiroidismo di origine autoimmune è così comune nella TS che quasi tutte le altre donne con TS svilupperanno probabilmente ipotiroidismo e aumentano con l'età [16, 17].
Sappiamo di più sui dettagli minori degli AITD, ma la domanda principale rimane senza risposta: perché la tiroide è così incline alle malattie autoimmuni? Questa revisione cerca di enfatizzare il ruolo delle cellule tiroidee di per se negli AITD e di focalizzare l'attenzione su fattori esogeni prevenibili.
Specificità delle cellule tiroidee
La cellula tiroidea produce una varietà di fattori immunologicamente attivi (tabella 1) e ha requisiti nutritivi complessi per la sintesi e la funzione ormonali (tabella 2), entrambi i quali influenzano la suscettibilità agli AITD. Pertanto, la cellula tiroidea non è solo la vittima innocente di un sistema immunitario incontrollato e disordinato. È sempre più evidente che le cellule bersaglio interagiscono con il sistema immunitario, spesso in modi che sembrano difensivi e protettivi, eppure possono andare in tilt e esacerbare l'autoimmunità in particolari circostanze [11].

 Nella maggior parte delle malattie autoimmuni umane, gli eventi che provocano l'autoimmunità rimangono elusivi. Ancora più importante, non è chiaro se l'autoimmunità derivi principalmente da un difetto immunitario, sia secondaria alle alterazioni dell'organo bersaglio, o entrambe. La tiroide mostra un aumento dell'assorbimento di iodio e dell'ossidazione prima dell'infiltrazione linfocitica concomitante con la diminuzione della proliferazione delle cellule epiteliali della tiroide in vitro. La modifica della funzione tiroidea influenza lo sviluppo dell'autoimmunità tiroidea [18]. La cellula tiroidea, a differenza di altre cellule epiteliali nel sistema endocrino, è unica perché rilascia prodotti ormonali sulla sua superficie basale invece della sua superficie apicale, consentendo così il traffico di preziosi iodio due volte attraverso la cellula.
Nella maggior parte delle malattie autoimmuni umane, gli eventi che provocano l'autoimmunità rimangono elusivi. Ancora più importante, non è chiaro se l'autoimmunità derivi principalmente da un difetto immunitario, sia secondaria alle alterazioni dell'organo bersaglio, o entrambe. La tiroide mostra un aumento dell'assorbimento di iodio e dell'ossidazione prima dell'infiltrazione linfocitica concomitante con la diminuzione della proliferazione delle cellule epiteliali della tiroide in vitro. La modifica della funzione tiroidea influenza lo sviluppo dell'autoimmunità tiroidea [18]. La cellula tiroidea, a differenza di altre cellule epiteliali nel sistema endocrino, è unica perché rilascia prodotti ormonali sulla sua superficie basale invece della sua superficie apicale, consentendo così il traffico di preziosi iodio due volte attraverso la cellula.
Le cellule tiroidee sono in grado di produrre diversi fattori (tabella 1), tra cui IGF I, IGF II e EGF, che possono stimolare l'angiogenesi. L'emivita di queste molecole è breve e inducono solo effetti locali (non sistemici). Le cellule follicolari tiroidee stimolate secernono diversi fattori di crescita [19]. L'espressione della molecola di adesione intercellulare 1 (ICAM-1) e l'antigene-3 associato alla funzione dei linfociti (LFA-3) da parte delle cellule tiroidee è potenziata da IFN-, fattore di necrosi tumorale (TNF) e interleuchina (IL) -1. Le cellule tiroidee esprimono CD44, che agisce come recettore hominguronan, media la rotazione dei leucociti (il primo passo nella ricerca tissutale) e può (come ICAM-1) indurre l'attivazione dei linfociti in determinate circostanze. È noto che le cellule tiroidee producono molte citochine (specialmente dopo la stimolazione con IL-1), tra cui IL-1, IL-6, IL-8, IL-12, IL-13 e IL-15 [11]. I linfociti attivati possono produrre TSH, che potrebbe avere una varietà di implicazioni [20].
La tolleranza a basse dosi può essere facilmente interrotta e la tiroide non è ben tollerata dal sistema immunitario. Gli autoantigeni negli AITD, come in altre malattie endocrine autoimmuni, includono recettori di membrana tessuto-specifici, enzimi e ormoni secreti. Le risposte autoimmuni cellulari e anticorpali miste sono probabilmente patogene in una certa misura. Gli autoanticorpi circolanti anti-Tg si trovano anche in GD e CAT, così come gli autoanticorpi contro la triiodotironina (T3) e la tiroxina (T4). Il TSHR umano (h) è il principale bersaglio antigenico nell'ipertiroidismo autoimmune [21]. È improbabile che l'autoanticorpo TPO abbia molta importanza patogena poiché ha un accesso limitato al TPO in vivo a causa della sua posizione all'interno della cellula. Inoltre, gli autoanticorpi anti-TPO non inibiscono l'attività dell'enzima. Pertanto, il loro valore clinico è principalmente quello di documentare l'autoimmunità tiroidea. Tuttavia, il TPO può agire come un antigene nascosto poiché non è adiacente al sistema vascolare.
Nell'uomo, l'eccesso di ormone tiroideo determina l'attenuazione dell'attività delle cellule natural killer (NK), che in teoria potrebbe portare alla continuazione di una malattia autoimmune. Dopo il ritorno a uno stato eutiroideo e la conseguente normalizzazione dell'attività NK, si verificherà una reversione al controllo della reazione immunitaria anormale con perpetuazione di GD. Inoltre, un anti-idiotipo potrebbe funzionare come un agonista per l'antigene originale. Pertanto, un anticorpo di un anticorpo (anti-idiotipo) a TSH potrebbe legarsi al TSHR e stimolare la tiroide [22]. Un'ipotesi più probabile è che gli anticorpi anti-idiotipici vengano prodotti raramente a un livello rilevabile. Hodkinson et al. [23] ha recentemente trovato un'associazione positiva tra la concentrazione dell'ormone tiroideo e le cellule T NK-like negli anziani. Questa relazione non è stata studiata in pazienti giovani.
Presentazione dell'antigene da parte della cellula tiroidea
Bottazzo et al. [24] ha inizialmente suggerito che la presentazione dell'antigene da parte delle cellule tiroidee che esprimono HLA-DR può essere un aspetto critico della malattia autoimmune della tiroide. È diventato subito evidente che l'unico stimolo in grado di indurre l'espressione di MHC di classe II su cellule tiroidee era la citochina delle cellule T IFN-. Le cellule normali rispondono esattamente come le cellule tiroidee di AITD all'IFN-, e nei modelli animali di AITD l'espressione di classe II sulle cellule tiroidee è sempre seguita dalla comparsa di linfociti nella ghiandola. Oltre a indurre l'espressione MHC di classe II, l'IFN- aumenta l'espressione di MHC di classe I sulle cellule tiroidee, consentendo così il potenziale per il riconoscimento delle cellule tiroidee da parte di cellule citotossiche CD8 + T [11].
È possibile che la presentazione diretta dell'antigene da parte della cellula tiroidea stessa possa verificarsi in individui che ereditano cellule T reattive alla tiroide; tale circostanza aggirerebbe efficacemente il meccanismo classico di elaborazione dei macrofagi. La cellula tiroidea che esprime l'antigene HLA-DR può essere efficace quanto il macrofago nel presentare antigeni tiroidei specifici al sistema immunitario [25], ma la cellula tiroidea non è in grado di fornire i segnali costimolatori che le cellule presentanti l'antigene professionale (APC) fare [11]. Qualsiasi stimolo che causa un aumento dell'espressione DR sui tireociti, come l'IFN- prodotto dalle cellule T in risposta all'infezione, combinato con una maggiore stimolazione del TSH può consentire ai tireociti di funzionare come APC. Sebbene le cellule tiroidee possano svolgere questa funzione in modo insoddisfacente, sono numerose e localizzate in un'area, consentendo quindi una maggiore produzione dei già bassi livelli di anticorpi normalmente esistenti (12).
Fattori ambientali
Un certo numero di fattori ambientali sono stati implicati nello sviluppo dell'AITD in individui geneticamente predisposti, tra cui un'elevata assunzione di iodio, carenza di Se, inquinanti come il fumo di tabacco, malattie infettive, alcuni farmaci e stress fisico ed emotivo [26-30]. Qui ci concentriamo su questi trigger prevenibili. La suscettibilità individuale suggerisce che, oltre alla genetica, anche alcuni fattori endogeni sono importanti per lo sviluppo di AITD, come gli impulsi di crescita durante l'infanzia, la pubertà, la gravidanza, la menopausa, l'invecchiamento e il sesso (fig.1, 2).
 Iodio
Iodio
Lo iodio alimentare svolge un ruolo importante nell'espressione degli AITD. Studi epidemiologici hanno suggerito che gli AITD sono più comuni nelle aree di sufficienza dello iodio rispetto alle aree di carenza di iodio e che aumenti generali degli AITD si verificano parallelamente all'aumento di iodio nella dieta. CAT è meno comune nei paesi con una bassa assunzione di iodio [27].
La tiroide richiede la giusta quantità di iodio. O troppo o troppo poco causa problemi. Troppo poco l'io porta in gioco tutti i meccanismi immunitari adattativi della tiroide, ma nonostante queste risposte possono ancora insorgere disturbi da carenza di iodio. Troppo iodio colpisce anche la tiroide. I meccanismi protettivi comprendono la diminuzione dell'intrappolamento dello ioduro da parte della tiroide e la diminuzione dell'organizzazione dello ioduro. Nella tiroidite sperimentale sono stati trovati diversi tipi di epitopi di Tg, compresi alcuni contenenti iodio e / o ormoni nonché alcuni epitopi conformazionali. L'aumento sperimentale della iodurazione della Tg rende la proteina più antigenica [28, 31]. In modo ottimale, l'assunzione di iodio di una popolazione dovrebbe essere mantenuta entro un intervallo relativamente stretto che previene i disturbi da iodio, ma non più elevati [29].
Il meccanismo d'azione dello iodio nel contribuire all'autoimmunità tiroidea non è chiaro. Lo iodio può stimolare i linfociti B per aumentare la produzione di immunoglobuline e quindi indurre AITD aumentando l'attività dei linfociti che sono stati innescati da antigeni tiroide-specifici [30]. Lo iodio può migliorare le capacità antigene-presentanti dei macrofagi, con conseguente aumento dell'attività dei macrofagi e aumento della stimolazione dei linfociti. Inoltre, un'elevata assunzione di iodio aumenta il contenuto di iodio della molecola Tg, che può aumentare la sua immunogenicità [31]. Infine, lo iodio può provocare cellule follicolari tiroidee a diventare APC e quindi potenziare gli AITD trasformando geneticamente predistirociti normali posti in tirociti presentanti l'antigene.
Tabella 2 mostra diversi minerali e oligoelementi essenziali per il normale metabolismo degli ormoni tiroidei. Il ruolo di questi elementi negli AITD dell'infanzia non è stato ben studiato.
Selenio
Il secondo fattore che è stato fortemente implicato nello sviluppo della tiroidite autoimmune è l'oligoelemento Se. Se è un costituente delle selenoproteine (SeP), in cui è incorporato come selenocisteina. Le azioni pertinenti di Se e SeP includono effetti antiossidanti, funzionamento appropriato del sistema immunitario, effetti antivirali, influenza sulla fertilità e un effetto benefico sull'umore [32]. Si ritiene che la carenza di Se sia coinvolta nella patogenesi della tiroidite autoimmune allungando la durata e esacerbando la gravità della malattia; questi effetti possono verificarsi tramite una ridotta attività della perossidasi di glutatione SeP, che porta ad un aumento della produzione di perossido di idrogeno. Un'altra importante classe di SeP è la iodotironina selenodeiodonasi D1 e D2, che sono responsabili della produzione di T3 biologicamente attivo tramite 5 -deiodinazione nei tessuti extratiroidali [33, 34].
Le carenze combinate di Se e iodio portano a cretinismo mixedematoso. Un'adeguata nutrizione Se supporta la sintesi e il metabolismo dell'ormone tiroideo efficiente e protegge la ghiandola tiroide dai danni causati dall'eccessiva esposizione allo iodio. Nelle regioni con gravi carenze combinate di iodio e Se, è obbligatorio normalizzare la fornitura di Se prima dell'inizio dell'integrazione di iodio per prevenire l'ipotiroidismo [35].
Nella celiachia, l'incapacità di assorbire Se può modulare l'espressione genica di SeP e promuovere il danno della mucosa intestinale, e questa carenza potrebbe inoltre predisporre a complicazioni come AITD [34, 36].
Derumeaux et al. [37] ha scoperto un'associazione inversa tra lo stato di Se e il volume della tiroide e l'eco-struttura negli adulti francesi e ha concluso che Se può proteggere contro gli AITD. Duntas et al. [38] ha trovato effetti benefici nel trattamento di pazienti con tiroidite autoimmune con selenometionina per 6 mesi a causa della sua capacità di ridurre gli anticorpi anti-TPO. Nel gruppo trattato con LT4 in combinazione con Se, questi effetti erano molto evidenti nei primi mesi 3 e sono stati ulteriormente sostenuti dopo i mesi di trattamento con 6. Una sorprendente maggioranza dei pazienti ha riportato un miglioramento dell'umore e del benessere.
Inquinanti ambientali
Varie tossine e inquinanti ambientali sono stati implicati nell'induzione degli AITD.
I polifenili polialogenati sono composti comunemente usati con un'ampia varietà di applicazioni industriali. I bifenili polibromurati sono ritardanti di fiamma e i policlorobifenili (PCB) sono usati come lubrificanti, adesivi, inchiostri e plastificanti. Si sa che i PCB si accumulano in laghi e fiumi e successivamente nel tessuto adiposo di pesci e umani [27]. Questi composti potrebbero innescare gli AITD interferendo con il trasporto di ioduro e inducendo stress ossidativo. Vi sono prove che l'esposizione per PCB peri- parale riduce i livelli di ormone tiroideo nei cuccioli di ratto. Negli adulti, negli adolescenti e nei bambini da aree altamente esposte al PCB, la concentrazione di PCB nei campioni di sangue è risultata correlata negativamente con i livelli di ormoni tiroidei circolanti [39, 40]. Le popolazioni con esposizione a lungo termine a PCB hanno una maggiore prevalenza di anticorpi anti-TPO, che è probabilmente correlata agli effetti immunomodulatori dei PCB. Gli inquinanti delle emissioni delle automobili e dell'industria pesante, nonché l'inquinamento da carbone e i fungicidi agricoli sono anche implicati nello sviluppo di AITD [26, 27].
Il fumo è associato ad un aumentato rischio di sviluppare GD e ad un ridotto tasso di remissione dopo il trattamento con tionamide. Ancora più sorprendente è l'effetto del fumo sull'orbitopatia di Graves, che tende ad essere più grave nei fumatori [32, 41]. Il fumo potrebbe contribuire alla patogenesi della GD alterando la struttura del recettore della tireotropina, rendendolo più immunogenico e portando alla produzione di anticorpi stimolatori del recettore della tireotropina che reagiscono fortemente con il tessuto retroorbitale [41]. Il fumo induce l'attivazione policlonale delle cellule B e T e aumenta la presentazione degli antigeni da parte delle cellule danneggiate. L'ipossia può giocare un ruolo nell'orbitopatia di Graves perché i fibroblasti retrobulbari mostrano un aumento significativo della proliferazione e della produzione di glicosaminoglicani quando coltivati in condizioni ipossiche [42, 43]. Gli effetti del fumo dei genitori sulla funzione tiroidea nei feti o nei bambini di 1 anno [44] forniscono ulteriori informazioni sull'interrelazione tra fumo e disfunzione tiroidea. Quest'ultimo studio ha rilevato che i neonati le cui madri e padri fumavano avevano concentrazioni sieriche del cordone ombelicale più elevate di Tg e tiocianato rispetto ai bambini i cui genitori non fumavano. Il quadro clinico osservato negli adolescenti esposti al fumo passivo potrebbe essere dovuto alla stimolazione diretta dell'attività nervosa simpatica da parte della nicotina oltre all'aumento della secrezione dell'ormone tiroideo indotto dal fumo [45].
L'associazione di fumare con CAT è meno ben definita. Sebbene sia stata riportata una relazione con ipotiroidismo autoimmune o tiroidite postpartum, questa scoperta non è stata supportata dalla meta-analisi dei documenti pubblicati [32, 45].
infezioni
In alcuni individui, l'autoimmunità è il prezzo che deve essere pagato per l'eradicazione di un agente infettivo. Le infezioni sono state implicate nella patogenesi di diverse malattie autoimmuni, endocrine e non endocrine. Infezioni virali o batteriche potrebbero rappresentare un fattore di rischio per lo sviluppo di AITD. I virus sono stati a lungo sospettati di agenti eziologici in molte malattie autoimmuni, tra cui AITD; inoltre, una causa virale di AITD, che ha infettato la tiroide o le cellule immunitarie, è stata dimostrata in un modello aviario. Sebbene i virus possano essere probabilmente agenti eziologici negli AITD umani, questa possibilità rimane non dimostrata [25, 27, 30].
È stata osservata un'aumentata frequenza di anticorpi del virus dell'influenza B in un gruppo di pazienti con tireotossicosi. Inoltre, particelle tiroidei sono state trovate nelle tiroidi dei polli con tiroidite autoimmune, con particelle simili rilevate nelle tiroidi degli umani. L'evidenza sierologica delle precedenti malattie da stafilococco e streptococco è stata descritta in alcuni pazienti con AITD [27].
Alcune delle prove più evidenti che collegano gli agenti infettivi all'induzione degli AITD è stata l'associazione dell'infezione da Yersinia enterocolitica con malattia della tiroide. Questo coccobacillo gram-negativo causa comunemente diarrea e una varietà di anomalie che suggeriscono malattie autoimmuni, tra cui artralgie, artrite, eritema nodoso, cardite, glomerulonefrite e irite. Weiss et al. [46] ha dimostrato che Y. enterocolitica aveva un sito di legame saturabile, specifico per l'ormone, per il TSH dei mammiferi che assomigliava al recettore del TSH nella tiroide umana.
Una risposta immunitaria contro un antigene virale che condivide l'omologia con il TSHR può essere l'evento induttivo che alla fine porta all'autoimmunità dei TSHR [21]. È stata trovata un'associazione significativa tra epatite C e AITDs. È stato dimostrato che i titoli anticorpali anti-TPO aumentano alla fine del trattamento con IFN- in pazienti con virus dell'epatite C, e questi pazienti erano più suscettibili agli AITD rispetto ai pazienti affetti da epatite B. Questi pazienti devono essere sottoposti a screening per la tiroidite autoimmune prima e dopo il trattamento con IFN [47, 48].
L'infezione potrebbe indurre una risposta autoimmune da parte di vari meccanismi, come il mimetismo molecolare, poliattivazione di cellule T clonali da superantigeni microbici e aumento dell'espressione tiroidea di antigeni leucocitari umani [49]. L'infiammazione indotta da infezioni virali o da sostanze inquinanti può modificare le vie di segnalazione cellulare e influenzare l'attività delle cellule T e i profili di secrezione delle citochine [26].
farmaci
Diversi farmaci sono stati implicati nella patogenesi degli AITD. L'amiodarone è un farmaco contenente iodio con diversi effetti sulla funzione tiroidea. I titoli sierici degli anticorpi anti-TPO sono elevati in circa la metà dei pazienti che sviluppano l'ipotiroidismo indotto da amiodarone. È stato anche dimostrato che l'amiodarone influisce sulla funzione delle cellule T [27]. Gli anticorpi tiroidei sono scomparsi dalla circolazione 6 mesi dopo la sospensione di amiodarone [32].
Il litio, un gozzo proteico psicofarmaco e ben noto, ha dimostrato di inibire il rilascio di ormoni tiroidei. Gli anticorpi antitiroide si riscontrano più frequentemente in pazienti psichiatrici sottoposti a terapia con litio che in pazienti psichiatrici analoghi trattati con altri farmaci. L'aumento indotto dal litio delle concentrazioni sieriche di TSH potrebbe migliorare l'espressione autoantigena sulla superficie dei tireociti, esacerbando in tal modo le risposte autoimmuni [32, 50].
Altri agenti coinvolti nell'autoimmunità tiroidea sono IL-2 (fenomeni autoimmuni tiroidei con o senza ipotiroidismo), IFN- (disfunzione tiroidea, ipotiroidismo e presenza di autoanticorpi tiroidei), terapia antiretrovirale altamente attiva (HAART, possibile insorgenza di fenomeni autoimmuni tiroidei e disfunzione ) e Campath-1H, un anticorpo monoclonale umanizzato che ha come target l'antigene CD52 su linfociti e monociti usato dopo il trapianto (occorrenza di GD) [32].
Stress
Sebbene numerose segnalazioni aneddotiche abbiano associato l'insorgenza di AITD, e in particolare di GD, con eventi stressanti, è stato difficile ottenere prove obiettive. Sia lo stress psicologico, come il lutto, sia lo stress fisico, come un trauma o una malattia grave, sono stati implicati [27].
I meccanismi immunitari neuroendocrini responsabili degli effetti putativi dello stress all'inizio e del decorso della GD sono scarsamente definiti, ma potrebbero includere l'attivazione dell'asse HPA (sebbene ciò dovrebbe causare immunosoppressione) e il passaggio da una risposta immunitaria Th1 (mediata dalle cellule) a una risposta immunitaria Th2 (umorale) [32, 51].
Inoltre, le heat shock protein (HSP), che sono ben note proteine dello stress, potrebbero condividere epitopi con il TSHR. Heufelder et al. [52] ha scoperto che alti livelli di espressione di HSP-72 negli AITD possono riflettere uno stato di stress cellulare cronico, ma questo risultato potrebbe anche indicare una funzione immunomodulatoria di HSP-72 negli AITD. Le HSP sono proteine ubiquitarie e altamente conservate che vengono espresse in risposta a un'ampia varietà di insulti fisiologici e ambientali. Permettono alle cellule di sopravvivere in condizioni altrimenti letali. Le HSP sono state postulate come antigeni critici sia nelle malattie autoimmuni sia nei modelli sperimentali di autoimmunità [53, 54].
È stato dimostrato che il miglioramento dello stress mediante l'uso prolungato del bromazepam aumenta il tasso di remissione dell'ipertiroidismo dopo un ciclo di tionamide [55]. La relazione tra stress e CAT è meno evidente. I pazienti di Graves potrebbero essere stressati a causa di ipertiroidismo e non ipertiroidei a causa dello stress, mentre i pazienti con CAT non sono stressati perché sono eutiroidei o ipotiroidei [32]. Qualunque sia il meccanismo d'azione, lo stress può causare scompenso in un individuo geneticamente suscettibile e portare all'induzione o esacerbazione di una AITD.
Gravidanza e dopo il parto
Gli AIT tendono ad essere più frequenti nelle donne. La ragione di questa differenza legata al genere non è chiara e non è spiegata dal cromosoma X aggiuntivo nelle femmine [42]. La possibilità che i geni responsabili delle risposte immunitarie si trovino sul cromosoma X è stata considerata ma non confermata. Gli steroidi sessuali possono modificare le risposte immunitarie agendo direttamente sulle cellule immunitarie. Gli estrogeni sono noti stimolatori della secrezione di TSH, che potrebbe migliorare l'espressione di HLA-DR. La parità di per sé non sembra avere un ruolo significativo [32, 56].
L'accumulo di cellule fetali nella tiroide materna durante la gravidanza (tiroidite postpartum indolore) può indurre tiroidite autoimmune [57]. La gravidanza è accompagnata da una soppressione del sistema immunitario con uno spostamento dell'equilibrio Th1 / Th2 verso l'immunità Th2, un processo che ha lo scopo di proteggere il feto. Un possibile legame tra la gravidanza e l'insorgenza postpartum di AITD potrebbe essere rappresentato dal microchimerismo fetale. Le cellule fetali passano nella circolazione materna e possono persistere nel sangue materno. Il microchimerismo di presunta origine fetale è stato dimostrato in campioni di tessuto tiroideo di donne con precedenti gravidanze, in particolare in quelle con AITD. La persistenza di attivato Le cellule fetali intratiroidee possono influenzare l'autoimmunità tiroidea in donne geneticamente suscettibili modulando o addirittura dando inizio a risposte immunitarie materne in una reazione di trapianto contro l'ospite al termine della soppressione immunitaria correlata alla gravidanza. Tuttavia, non è possibile escludere che le cellule fetali intratiroidee siano solo innocenti e non partecipino a scatenare o esacerbare le risposte autoimmuni alla tiroide [32, 54, 58]. Le madri che hanno dato alla luce figli hanno cellule positive al cromosoma tiroideo Y più frequentemente se sono affette da CAT o GD rispetto a se hanno adenomi tiroidei [59].
La presenza di elevati anticorpi anti-TPO in circa 10% delle donne in gravidanza è associata ad un aumentato rischio di aborto spontaneo, disfunzione gestazionale della tiroide e tiroidite postpartum [48]. Il trasferimento materno-fetale di anticorpi TSHR con attività policlonale e un'emivita diversa può portare a una disfunzione transitoria della tiroide perinatale, opposta a quella materna [60].
Conclusione
Un corpo in rapida crescita di prove sull'interazione tra fattori genetici, ambientali ed endogeni ha ampliato la nostra conoscenza della complessa eziopatogenesi degli AITD. I disordini tiroidei autoimmuni sono esempi di malattie comuni in cui i fattori immunogenetici giocano un ruolo importante.
La stessa cellula tiroidea sembra svolgere un ruolo importante nella progressione della malattia interagendo con il sistema immunitario. La complessità della sintesi ormonale, i requisiti unici dell'oligestione e le capacità specifiche del sistema di difesa delle cellule tiroide probabilmente rendono la tiroide incline agli AITD. L'insulto iniziale alla ghiandola tiroidea umana che attiva l'insorgenza di AITD rimane sconosciuto e sembra essere fortemente individuale. Comprendere di più sull'interazione tra i geni e l'ambiente potrebbe produrre percorsi completamente nuovi, alcuni dei quali potrebbero essere semplici come identificare la necessità di evitare il fumo o controllare l'assunzione di particolari nutrienti. La prova di molti agenti causali è, tuttavia, scarsa, e sono sicuramente necessari ulteriori dati. Riteniamo che sia particolarmente importante attirare l'attenzione su questo problema nei pazienti pediatrici. Le lezioni apprese dalle domande enigmatiche sollevate negli studi dell'AITD potrebbero chiarire la patogenesi di altre malattie autoimmuni organo-specifiche.
L. Saranac S. Zivanovic B. Bjelakovic H. Stamenkovic M. Novak B. Kamenov Clinica pediatrica, Centro clinico universitario, Nis, Serbia
luminoso
Riferimenti:
1 Phillips DI, Osmond C, Baird J, Huckle A,
Rees-Smith B: è associato al peso alla nascita
autoimmunità tiroidea? Uno studio in gemelli.
Tiroide 2002; 12: 377-380.
2 Brix TH, Hansen PS, Rudbeck AB, Hansen
JB, Skythe A, Kyvik KO, Hegedus L: Low
il peso alla nascita non è associato alla tiroide
autoimmunità: un gemello basato sulla popolazione
studia. J Clin Endocrinol Metab 2006; 91:
3499 3502.
3 Wilkin TJ: il grande esperimento di aumento di peso,
acceleratori e le loro implicazioni per
autoanticorpi nel diabete. Arch Dis Child
2006; 91: 456 458.
4 Matarese G, La Cava A, Sanna V, Lord MG,
Lechler RI, Fontana S, Zappacosta S: Bilanciamento
suscettibilità alle infezioni e autoimmunità:
un ruolo di leptina? Tendenze Immunol
2002; 23: 182 187.
5 Radetti G, Kleon W, Buzi F, Crivellero C,
Pappalardo L, Di Lorgi N, Maghnie M: Tiroide
struttura e funzione sono interessate in
obesità infantile. J Clin Endocrinol Metab
2008; 93: 4749 4754.
6 Pacifico L, Di Renzo L, Anania C, Osborn JF,
Ippoliti F, Schiavo E, Chiesa C: aumento del Thelper
celle di secrezione di interferone-gamma in
bambini obesi. Eur J Endocrinol 2006; 154:
691 697.
7 Marras V, Casini MR, Pilia S, Carta D, Civolani
P, Porcu M, Uccheddu AP, Loche S: Tiroide
funzione nei bambini e negli adolescenti obesi.
Horm Res Paediatr 2010; 73: 193-197.
8 Saranac L, Zivanovic S, Novak M: High fT3
(triiodotironina libera), nuova sindrome o innocente
astanti. Abstracts Endocrici Eur
Congr Endocrinol, Praga, 2010, p 771.
9 Schwartz M, Cohen IR: autoimmunità can
beneficio auto-manutenzione. Immunol oggi
2000; 21: 265 268.
10 Cohen IR, Schwartz M: manutenzione autoimmune
e neuroprotezione della centrale
sistema nervoso. J Neuroimmunol 1999; 100:
111 114.
11 Weetman AP: malattia tiroidea autoimmune:
propagazione e progressione. Eur J Endocrinol
2003; 148: 1 9.
12 Weetman AP: nuovi aspetti dell'autoimmunità tiroidea.
Horm Res 1997; 48 (suppl 4): 51
54
13 Jacobson EM, Tomer Y: il CD40, CTLA-4,
tireoglobulina, recettore del TSH e PTPN22
quintetto genico e il suo contributo alla tiroide
autoimmunità: ritorno al futuro. J Autoimmun
2007; 28: 85 98.
14 Tomer Y, Huber A: L'eziologia dell'autoimmune
malattia della tiroide: una storia di geni e
ambiente. J Autoimmun 2009; 32: 231
239
15 Saenger P: Sindrome di Turner; in Sperling MA
(ed): Endocrinologia pediatrica, ed 3. Philadelphia,
Saunders Elsevier, 2008, pagg. 610.
16 El-Mansoury M, Bryman I, Berntorp K,
Hanson C, Wilhelmsen L, Landin-Wilhelmsen
K: L'ipotiroidismo è comune a Turner
sindrome: risultati di un follow up di cinque anni.
J Clin Endocrinol Metab 2005; 90: 2131-2135.
17 Mortensen KH, Cleemann L, Hjerrild BE,
Nexo E, Locht H, Jeppesen EM, Gravholt
CH: aumento della prevalenza di autoimmunità
nella sindrome di Turner influenza dell'età. Clin
Experim Immunol 2009; 156: 205-210.
18 Homo-Delarche F, Boitard C: Autoimmune
diabete: il ruolo delle isole di Langerhans.
Immunol Today 1996; 17: 456-460.
19 Denef JF, Ovaert C, Many MC: Experimental
goitrogenesi (in francese). Ann Endocrinol
(Parigi) 1989; 50: 1 15.
20 Fabry Z, Raine CS, Hart MN: tessuto nervoso
come compartimento immune: il dialetto di
la risposta immunitaria nel sistema nervoso centrale. Immunol
Oggi 1994; 15: 218-224.
21 Song YH, Li Y, Maclaren NK: La natura di
autoantigeni bersagliati nell'endocrino autoimmune
malattie. Immunol Today 1996; 17: 232
238
22 Zakarija M, McKenzie JM: lo spettro
e significato degli autoanticorpi che reagiscono
con il recettore della tireotropina. Endocrinol
Metab Clin North Am 1987; 16: 343-364.
23 Hodkinson CF, Simpson EEA, Beattie JH,
O Conor JM, Campbell DJ, Strain JJ, Wallace
JM: prova preliminare della funzione immunitaria
modulazione da parte degli ormoni tiroidei in
uomini e donne sani di età compresa tra 55 e 70 anni. J
Endocrinol 2009; 202: 55.
24 Botazzo GF, Pujol-Borrell R, Hanafusa T,
Feldmann M: Ruolo di aberrante espressione di HLA-DR
e presentazione dell'antigene in induzione
di autoimmunità endocrina. Lancetta
1983; 2: 1115 1119.
25 Davies TF, Piccini LA: Intrathyroidal MHC
espressione dell'antigene di classe II e autoimmunità tiroidea.
Endocrinol Metab Clin North
Am 1987; 16: 247-268.
26 Duntas LH: fattori ambientali e autoimmuni
tiroidite. Nat Clin Pract Endocrinol
Metab 2008; 4: 454-460.
27 Safran M, Paul TL, Roti E, Braverman LE:
Fattori ambientali che influenzano l'autoimmunità
malattia della tiroide. Endocrinolo Metab
Clin North Am 1987; 6: 327-342.
28 Dunn JT: Cosa sta succedendo con il nostro iodio?
J Clin Endocrinol Metab 1998; 3398
3400
29 Laurberg P, Cerqueira C, Ovesen L, Rasmusen
LB, Perrild H, Andersen S, Pedersen IB,
Carle A: assunzione di iodio come determinante di
disturbi della tiroide nella popolazione. Best Pract
Res Clin Endocrinol Metab 2010; 24: 13 27.
30 Weetman AP, McGregor AM: Autoimmune
malattia della tiroide: sviluppi nella nostra comprensione.
Endocr Rev 1984; 5: 309 355.
31 Carayanniotis G, Rao VP: Ricerca per
epitopi patogeni nella tireoglobulina: parametri
e avvertimenti. Immunol Today 1997;
18: 83.
32 Bartalena L, Tanda ML, Piantanida E, Lai A,
Compri E, Lombardi V: Ambiente e
autoimmunità tiroidea; in Wiersinga WM,
Drexhage HA, Weetman AP, e altri (a cura di): The
Tiroide e autoimmunità: Merck europeo
Tiroide Symposium Noordwijk 2006,
15-18 giugno. Stoccarda, Thieme, 2007 pagg.60
73
33 Berry MJ, Bany L, Larsen PR: iodotironina di tipo I
la deiodinasi è un contenente selenocisteina
enzima. Nature 1991; 349: 438-440.
34 Duntas LH: selenio e infiammazione:
meccanismi antinfiammatori sottostanti.
Horm Metab Res 2009; 41: 443.
35 Zimmerman MB, Kohrle J: L'impatto di
carenze di ferro e di selenio su iodio e
metabolismo tiroideo: biochimica e rilevanza
per la salute pubblica. Tiroide 2002; 12:
867 878.
36 Duntas LH: la malattia celiaca si innesca autoimmune
tiroidite. Nat Rev Endocrinol
2009; 5: 190 191.
37 Derumeaux E, Valeix P, Castetbon K, Bensimon
M, Boutron-Ruault MC, Arnaud JH,
Hercberg S: Associazione del selenio con
volume tiroideo ed ecostruttura in 35- a
60-anno-vecchi adulti francesi. Eur J Endocrinol
2003; 148: 309 315.
38 Duntas LH, Mantzou E, Koutras DA: Effetti
di un trattamento di sei mesi con selenometionina
in pazienti con tiroidite autoimmune.
Eur J Endocrinol 2003; 148: 389.
39 Meerts IA, Assink Y, Cenijn PH, Van Den
Berg JH, Weijers BM, Bergman A, Koeman
JH, Brouwer A: trasferimento placentare di un idrossilato
bifenile policlorurato ed effetti
sull'ormone tiroideo fetale e materno
omeostasi nel ratto. Toxicol Sci 2002; 68:
361 372.
40 Boas M, Feldt-Rasmussen U, Skakkebaek
NE, KM principale: prodotti chimici ambientali
e la funzione della tiroide. Eur J Endocrinol 2006;
154: 599.
41 Utiger RD: effetti del fumo sulla tiroide
funzione. Eur J Endocrinol 1998; 138: 368
369
42 Prummel MF, Strieder T, Wiersinga WM:
L'ambiente e le malattie autoimmuni.
Eur J Endocrinol 2004; 150: 605.
43 Pontikides N, Krassas GE: Influenza della sigaretta
fumare sulla funzione tiroidea, gozzo
formazione e disordini tiroidei autoimmuni.
Ormoni (Atene) 2002; 1: 91.
44 Gasparoni A, Autelli M, Ravagni-Probizer
MF, Bartoli A, Regazzi-Bonora M, Chirico
G, Rondini G: Effetto del fumo passivo su
funzione tiroidea nei neonati. Eur J Endocrinol
1998; 138: 379 382.
45 Vestergaard P: Disturbi del fumo e della tiroide
una meta-analisi. Eur J Endocrinol
2002; 146: 153 161.
46 Weiss M, Ingbar SH, Winblad S, Kasper DL:
Dimostrazione di un sito di rilegatura saturabile per
tireotropina in Yersinia enterocolitica. Scienza
1983; 219: 1331 1333.
47 Fernandez-Soto L, Gonzales A, Escobar-Jimenez
F, Vazquez R, Ocete E, Olea N, Salmeron
J: Aumento del rischio di tiroide autoimmune
malattia nell'epatite C vs B prima, durante e
dopo aver interrotto la terapia con interferone. Arco
Intern Med 1998; 158: 1445-1448.
48 Testa A, Castaldi P, Fanti V, Fiore GF, Grieco
V, De Rosa A, Pazardjklian MG, De Rosa G:
Prevalenza degli anticorpi anti-HCV in autoimmune
malattia della tiroide. Eur Rev Med Pharmacol
Sci 2006; 10: 183-186.
49 Davies TF: infezione e tiroide autoimmune
malattia. J Clin Enocrinol Metab 2008; 93:
674 676.
50 Lazarus JH, John R, Bennie EH, Chalmers
RJ, Crockett G: terapia al litio e tiroide
funzione: uno studio a lungo termine. Psychol Med
1981; 11: 85 92.
51 Dayan CM: Eventi di vita stressanti e tombe
malattia rivisitata. Clin Endocrinol (Oxf)
2001; 55: 13 14.
52 Heufelder AE, Goellner JR, Wenzel BE,
Bahn RS: rilevamento immunoistochimico
e localizzazione di un calore 72-kilodalton
shock proteico nella malattia della tiroide autoimmune.
J Clin Endocrinol Metab 1992; 74: 724
731
53 Parcellier A, Gurbuxani S, Schmitt E, Solary
E, Garrido C: proteine dello shock termico, cellulare
chaperones che modula il mitocondrio
percorsi di morte cellulare. Biochem Biophys Res
Comun 2003; 304: 505-512.
54 Gaston JS: Sono coinvolte le proteine da shock termico
nell'autoimmunità? Int Clin Lab Res 1992; 22:
90 94.
55 Benvenga S: Benzodiazepine e remissione
della malattia di Graves. Tiroide 1996; 6: 659.
56 Adams D: Come funziona il sistema immunitario
e perché causa malattie autoimmuni. Immunol
Oggi 1998; 17: 300-303.
57 Pierce EN, Farwel AP, Braverman LE: Tiroidite.
N Engl J Med 2003; 348: 2646-2655.
58 Badenhoop K: Microchimerismo e il
modello di tiroidite postpartum; a Wiersinga
WM, Drexhage HA, Weetman AP, et
al (eds): The Thyroid and Autoimmunity:
Merck European Thyroid Symposium
Noordwijk 2006, 15-18 giugno. Stoccarda,
Thieme, 2007, pagg. 99-103.
59 Szabolcs I: rilevanza clinica della perossidasi tiroidea
autoanticorpi negli individui eutiroidei;
in Wiersinga WM, Drexhage HA,
Weetman AP, et al (eds): The Thyroid e
Autoimmunità: Merck European Thyroid
Symposium Noordwijk 2006, 15-18 giugno.
Stoccarda, Thieme, 2007, pagg. 133 142.
60 Saranac L, Miljkovic M, Stamenkovic H, Mileusnic-Milenovic
R, Petrovic G, Kamenov
B: disfunzione tiroidea transitoria a insorgenza tardiva
nei bambini nati da madri con autoimmune
malattia della tiroide. Facta Univ Ser Med
Biol 2003; 10: 52.
Chiudi fisarmonica
Le informazioni qui riportate su "Perché la tiroide è così incline alle malattie autoimmuni?" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato a chiropratica, muscolo-scheletrico, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato lo studio o gli studi di ricerca pertinenti a sostegno dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Autorizzato come infermiere registrato (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale